
| A. | C3H6、CH2═CHCH3 | B. | H2O2、 | C. |  | D. |  1S22S22p63S23p6 1S22S22p63S23p6 |
分析 A、C3H6可以代表环丙烷、CH2═CHCH3是丙烯;
B、H2O2是双氧水的分子式、 是双氧水的电子式;
是双氧水的电子式;
C、 ,前者是甲烷、后者是四氯化碳;
,前者是甲烷、后者是四氯化碳;
D、 是Ne的原子结构示意图,1S22S22p63S23p6可能是K+、Cl-等.
是Ne的原子结构示意图,1S22S22p63S23p6可能是K+、Cl-等.
解答 解:A、C3H6可以代表环丙烷、CH2═CHCH3是丙烯,二者不是同种微粒,故A错误;
B、H2O2是双氧水的分子式、 是双氧水的电子式,二者一定代表同种微粒,故B正确;
是双氧水的电子式,二者一定代表同种微粒,故B正确;
C、 ,前者是甲烷、后者是四氯化碳,二者不是同种微粒,故C错误;
,前者是甲烷、后者是四氯化碳,二者不是同种微粒,故C错误;
D、 是Ne的原子结构示意图,1S22S22p63S23p6可能是K+、Cl-等,二者不是同种微粒,故D错误;
是Ne的原子结构示意图,1S22S22p63S23p6可能是K+、Cl-等,二者不是同种微粒,故D错误;
故选B.
点评 本题考查微粒的表示方法及其意义,难度不大,掌握其定义和特征是解题的关键,注意同分异构体和同种物质的区别.


科目:高中化学 来源: 题型:选择题

| A. | CO和O生成CO2是吸热反应 | |
| B. | 在该过程中,CO断键形成C和O | |
| C. | CO和O生成了具有极性共价键的CO2 | |
| D. | 状态Ⅰ→状态Ⅲ表示CO与O2反应的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
| E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
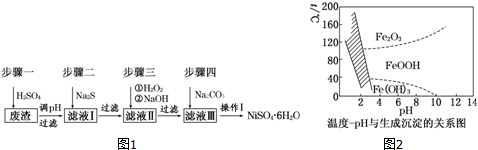
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
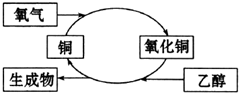
| A. | 生成物是乙醛 | B. | 乙醇发生了还原反应 | ||
| C. | 铜是此反应的催化剂 | D. | 反应中有红黑颜色交替变化的现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯化银的悬浊液中加入氯化钠溶液,Ksp(AgCl)减小 | |
| B. | 饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大 | |
| C. | 若向0.0008mol•L-1的K2CrO4溶液中加入等体积0.002 mol•L-1的AgNO3溶液,则CrO42--完全沉淀 | |
| D. | 若将0.001mol•L-1AgNO3溶液滴入浓度均为0.001 mol•L-1的KCl和K2CrO4混合溶液中,则先产生AgCl沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 O3氧化海水中I-是大气中碘的主要来源.将O3通入稀硫酸酸化的NaI溶液中进行模拟研究,发生反应如下:
O3氧化海水中I-是大气中碘的主要来源.将O3通入稀硫酸酸化的NaI溶液中进行模拟研究,发生反应如下: .
.| 实验编号 | 实验目的 | 反应物 | 温度 | 反应前溶液的pH |
| A | 对照组 | O3+NaI+H2SO4 | 25℃ | 5.2 |
| B | 研究FeCl2对I3-生成速率的影响 | O3+NaI+H2SO4+FeCl2 | 25℃ | 5.2 |
| C | 研究温度对I3-生成速率的影响 | O3+NaI+H2SO4 | 5℃ | 5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 事实 | 现象或解释 |
| A | 不法分子燃烧硫磺熏制银耳 | 二氧化硫有还原性 |
| B | 可用浓氨水检验输送煤气的管道是否有泄漏 | 出现白烟处是煤气泄漏点 |
| C | 泡沫灭火器使用的物质是硫酸铝和碳酸钠 | 二者混合发生双水解反应生成二氧化碳和氢氧化铝 |
| D | 医院里常用来紫外线灯进行杀菌消毒 | 紫外线能使蛋白质变性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com