
 ijĪĀ¶ČĻĀ£¬ŌŚ2LĆܱÕČŻĘ÷ÖŠ£¬·¢ÉśNO2ŗĶN2O4Ö®¼äµÄ·“Ó¦£ŗN2O4£Øg£©?2NO2£Øg£©£¬ø÷ĪļÖŹµÄĮæĖꏱ¼äµÄ±ä»Æ¹ŲĻµČēĶ¼ĖłŹ¾£¬
ijĪĀ¶ČĻĀ£¬ŌŚ2LĆܱÕČŻĘ÷ÖŠ£¬·¢ÉśNO2ŗĶN2O4Ö®¼äµÄ·“Ó¦£ŗN2O4£Øg£©?2NO2£Øg£©£¬ø÷ĪļÖŹµÄĮæĖꏱ¼äµÄ±ä»Æ¹ŲĻµČēĶ¼ĖłŹ¾£¬·ÖĪö £Ø1£©øł¾ŻøĆ·“Ó¦Õż·“Ó¦ĪŖĘųĢåĢå»żŌö“óµÄ·“Ó¦·ÖĪö£»
£Ø2£©øł¾ŻĪļÖŹµÄĮæµÄ±ä»ÆĮæÖ®±ČµČÓŚ¼ĘĮæŹżÖ®±Č·ÖĪö£»
£Ø3£©øł¾ŻĘ½ŗā³£ŹżK=$\frac{c£ØNO{\;}_{2}£©{\;}^{2}}{c£ØN{\;}_{2}O{\;}_{4}£©}$¼ĘĖć£»
£Ø4£©øł¾Żv=$\frac{”÷c}{”÷t}$¼ĘĖć·“Ó¦ĖŁĀŹ£¬½įŗĻĶ¼Ļó¼ĘĖćĻą¹ŲĪļĄķĮ棻
£Ø5£©ČōÉżøßĪĀ¶ČÕżÄę·“Ó¦ĖŁĀŹ¶¼Ōö“ó£¬Ę½ŗāĻņĪüČČ·“Ó¦·½ĻņŅĘ¶Æ£»
£Ø6£©øł¾ŻæÉÄę·“Ó¦“¦ÓŚĘ½ŗāדĢ¬Ź±£¬ÕżÄę·“Ó¦ĖŁĀŹĻąµČ”¢×é³É²»±äµČĢŲÕ÷ÅŠ¶Ļ£»
£Ø7£©ŌŚ²ā¶ØNO2µÄĻą¶Ō·Ö×ÓÖŹĮæŹ±£¬ŌņŹ¹Ę½ŗāĻņÕż·“Ó¦·½Ļņ½ųŠŠ¼“æÉŹ¹²ā¶Ø½į¹ū×ī½Ó½üĄķĀŪÖµ£¬¾Ż“ĖÅŠ¶Ļ£®
½ā“š ½ā£ŗ£Ø1£©ŅņĪŖøĆ·“Ó¦Õż·“Ó¦ĪŖĘųĢåĢå»żŌö“ó£¬ĖłŅŌ”÷S£¾0£¬¹Ź“š°øĪŖ£ŗ£¾0£»
£Ø2£©ÓÉ·½³ĢŹ½N2O4£Øg£©?2NO2£Øg£©£¬æÉÖŖ·“Ó¦ÖŠNO2 µÄĪļÖŹµÄĮæ±ä»Æ½Ļ“ó£¬ŌņY±ķŹ¾NO2µÄĪļÖŹµÄĮæĖꏱ¼äµÄ±ä»ÆĒśĻߣ¬¹Ź“š°øĪŖ£ŗY£»
£Ø3£©øł¾ŻĶ¼ĻóæÉÖŖĘ½ŗāŹ±£¬N2O4µÄÅضČĪŖ$\frac{0.7}{2}$=0.35mol/L£¬2NO2µÄÅضČĪŖ$\frac{0.4}{2}$=0.2mol/L£¬ĖłŅŌĘ½ŗā³£ŹżK=$\frac{c£ØNO{\;}_{2}£©{\;}^{2}}{c£ØN{\;}_{2}O{\;}_{4}£©}$=$\frac{0.2{\;}^{2}}{0.35}$=0.11£¬¹Ź“š°øĪŖ£ŗ0.11£»
£Ø4£©øł¾ŻĶ¼Ļóv£ØNO2£©=$\frac{\frac{1.0-0.4}{2}}{2}$=0.15mol/£ØL•min£©£¬¹Ź“š°øĪŖ£ŗ0.15mol/£ØL•min£©£»
£Ø5£©ÉżøßĪĀ¶Č£¬v£ØÕż£©¼Óæģ£¬v£ØÄę£©¼Óæģ£¬Ę½ŗāĻņĪüČČ·“Ó¦·½Ļņ¼“Õż·½ĻņŅĘ¶Æ£¬¹Ź“š°øĪŖ£ŗ¼Óæģ£»¼Óæģ£»
Õż£»
£Ø6£©¢Łµ„Ī»Ź±¼äÄŚÉś³Én mol N2O4µÄĶ¬Ź±Éś³É2n molNO2£¬ŌņÕżÄę·“Ó¦ĖŁĀŹĻąµČ£¬ĖµĆ÷“ļĘ½ŗāדĢ¬£¬¹ŹÕżČ·£»
¢ŚNO2ŗĶN2O4µÄĪļÖŹµÄĮæÅضČÖ®±ČĪŖ 2£ŗ1£¬Ī“ĢåĻÖÕżÓėÄęµÄ¹ŲĻµ£¬¹Ź“ķĪó£»
¢ŪNO2”¢N2O4 µÄ·“Ó¦ĖŁĀŹµÄ±ČĪŖ 2£ŗ1£¬Ī“ĢåĻÖÕżÓėÄęµÄ¹ŲĻµ£¬¹Ź“ķĪó£»
¢Ü»ģŗĻĘųĢåµÄŃÕÉ«²»ŌŁøı䣬Ōņ¶žŃõ»ÆµŖµÄÅØ¶Č²»±ä£¬ĖµĆ÷“ļĘ½ŗāדĢ¬£¬¹ŹÕżČ·£»
¢Ż»ģŗĻĘųĢåĒ°ŗóÖŹĮæ²»±ä£¬Ģå»żŅ²²»±ä£¬ĖłŅŌĆܶČŅ»Ö±²»±ä£¬Ōņ»ģŗĻĘųĢåµÄĆÜ¶Č²»ŌŁøıäĪ“ĢåĻÖÕżÓėÄęµÄ¹ŲĻµ£¬¹Ź“ķĪó£»
¢Ž»ģŗĻĘųĢåĒ°ŗóÖŹĮæ²»±ä£¬ĪļÖŹµÄĮæŌŚ±ä£¬ĖłŅŌĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæŅ»Ö±ŌŚ±ä£¬ĖłŅŌŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»ŌŁøı䣬ĖµĆ÷“ļĘ½ŗāדĢ¬£¬¹ŹÕżČ·£»
¢ßČŻĘ÷ÄŚŃ¹Ēæ²»ŌŁ·¢Éś±ä»Æ£¬ĖµĆ÷“ļĘ½ŗāדĢ¬£¬¹ŹÕżČ·£»
¢ąøĆ·“Ó¦ĪŖĪüČČ·“Ó¦£¬ĖłŅŌĘųĢåµÄĪĀ¶Č²»ŌŁ±ä»ÆĖµĆ÷“ļĘ½ŗāדĢ¬£¬¹ŹÕżČ·£»
¹ŹŃ”£ŗ¢Ł¢Ü¢Ž¢ß¢ą£»
£Ø7£©ŌŚ²ā¶ØNO2µÄĻą¶Ō·Ö×ÓÖŹĮæŹ±£¬ŌņŹ¹Ę½ŗāĻņÕż·“Ó¦·½Ļņ½ųŠŠ¼“æÉŹ¹²ā¶Ø½į¹ū×ī½Ó½üĄķĀŪÖµ£¬ÓÖøĆ·“Ó¦ĪŖĘųĢåĢå»żŌö“óµÄĪüČČ·“Ó¦£¬ĖłŅŌŹ¹Ę½ŗāĻņÕż·“Ó¦·½Ļņ½ųŠŠ¼“øßĪĀµĶŃ¹£¬¹ŹŃ”£ŗC£®
µćĘĄ ±¾Ģāæ¼²é½ĻĪŖ×ŪŗĻ£¬ĢāÄæÄѶČÖŠµČ£¬×¢Ņā°ŃĪÕ»Æѧ·“Ó¦ĖŁĀŹŅŌ¼°»ÆŃ§Ę½ŗāµÄ»ł±¾ÖŖŹ¶¼“æɽā“šøĆĢā£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
 ¼×”¢ŅŅĮ½ĪļÖŹµÄČܽā¶ČĒśĻßĻøĶ¼ĖłŹ¾£¬¼ŁÉčČÜŅŗµÄĆܶČĪŖpg•cm-3£¬ČÜÖŹµÄĦ¶ūÖŹĮæĪŖMg•mol-1£¬ČÜÖŹµÄĪļÖŹµÄĮæÅضČĪŖcmol•L-1£¬ŌņĻĀĮŠŠšŹöÕżČ·µÄŹĒ£Ø””””£©
¼×”¢ŅŅĮ½ĪļÖŹµÄČܽā¶ČĒśĻßĻøĶ¼ĖłŹ¾£¬¼ŁÉčČÜŅŗµÄĆܶČĪŖpg•cm-3£¬ČÜÖŹµÄĦ¶ūÖŹĮæĪŖMg•mol-1£¬ČÜÖŹµÄĪļÖŹµÄĮæÅضČĪŖcmol•L-1£¬ŌņĻĀĮŠŠšŹöÕżČ·µÄŹĒ£Ø””””£©| A£® | T1”ꏱ£¬¼×”¢ŅŅ±„ŗĶČÜŅŗµÄĪļÖŹµÄĮæÅضČŅ»¶ØĻąµČ | |
| B£® | T1”ęŗĶT2”ꏱ£¬¼×µÄ±„ŗĶČÜŅŗµÄÖŹĮæ·ÖŹżÖ®±ČĪŖ9£ŗ13 | |
| C£® | T1”ꏱ£¬ŌŚ100gĖ®ÖŠ¼ÓČė60gŅŅ£¬Ōņc£ØŅŅ£©=$\frac{1000”Į¦Ń£ØŅŅ£©”Į37.5%}{M£ØŅŅ£©}$ | |
| D£® | T1”ęŗĶT2”ꏱ£¬¼×µÄ±„ŗĶČÜŅŗµÄĪļÖŹµÄĮæÅضČÖ®±ČĪŖ9£ŗ13 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 10.0g C2H6 | B£® | ±ź×¼×“æöĻĀ5.6L æÕĘų | ||
| C£® | 1.0mol/LČÜŅŗÖŠHCl | D£® | 3.01”Į1023 øö³ōŃõ·Ö×Ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

| Fe2+ | Fe3+ | Cu2+ | Mn2+ | |
| æŖŹ¼³ĮµķµÄpH | 7.5 | 3.2 | 5.2 | 8.8 |
| ĶźČ«³ĮµķµÄpH | 9.7 | 3.7 | 7.8 | 10.4 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ł¢Ś¢Ū¢Ż | B£® | ¢Ł¢Ś¢Ü¢Ż | C£® | ¢Ł¢Ś¢Ū¢Ü | D£® | ¢Ū¢Ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ·ÖŅŗŹ±£¬·ÖŅŗĀ©¶·ÖŠĻĀ²ćŅŗĢå“ÓĻĀæŚ·Å³ö£¬ÉĻ²ćŅŗĢå“ÓÉĻæŚµ¹³ö | |
| B£® | ÕōĮóŹ±£¬Ó¦Ź¹ĪĀ¶Č¼ĘĖ®ŅųĒņĪ»ÓŚÕōĮóÉÕĘæÖ§¹ÜæŚ“¦ | |
| C£® | ÓĆ¾Ę¾«ŻĶČ”µāĖ®ÖŠµÄµā | |
| D£® | ³ĘĮæŹ±£¬½«·Å³ĘĮæÖ½»ņÉÕ±ÖŠµÄ³ĘĮæĪļÖĆÓŚĶŠÅĢĢģĘ½µÄ×óÅĢ£¬ķĄĀė·ÅŌŚĶŠÅĢĢģĘ½µÄÓŅÅĢ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
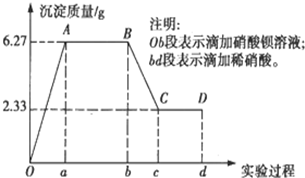 ij»Æѧъ¾æŠŌѧĻ°Š”×é¶ŌijĪŽÉ«Ė®ŃłµÄ³É·Ö½ųŠŠ¼ģŃ飬ŅŃÖŖøĆĖ®ŃłÖŠÖ»æÉÄÜŗ¬ÓŠK+”¢Mg2+”¢Fe3+”¢Cu2+”¢Al3+”¢Ag+”¢Ca2+”¢CO32-”¢SO42-”¢Cl-ÖŠµÄČōøÉÖÖĄė×Ó£®øĆŠ”×éĶ¬Ń§Č”100mLĖ®Ńł½ųŠŠŹµŃ飬ĻņĖ®ŃłÖŠĻȵĪ¼ÓĻõĖį±µČÜŅŗ£¬ŌŁµĪ¼Ó2mol/LµÄĻõĖį£¬ŹµŃé¹ż³ĢÖŠ³ĮµķÖŹĮæµÄ±ä»ÆĒéæöČēĶ¼ĖłŹ¾£ŗ
ij»Æѧъ¾æŠŌѧĻ°Š”×é¶ŌijĪŽÉ«Ė®ŃłµÄ³É·Ö½ųŠŠ¼ģŃ飬ŅŃÖŖøĆĖ®ŃłÖŠÖ»æÉÄÜŗ¬ÓŠK+”¢Mg2+”¢Fe3+”¢Cu2+”¢Al3+”¢Ag+”¢Ca2+”¢CO32-”¢SO42-”¢Cl-ÖŠµÄČōøÉÖÖĄė×Ó£®øĆŠ”×éĶ¬Ń§Č”100mLĖ®Ńł½ųŠŠŹµŃ飬ĻņĖ®ŃłÖŠĻȵĪ¼ÓĻõĖį±µČÜŅŗ£¬ŌŁµĪ¼Ó2mol/LµÄĻõĖį£¬ŹµŃé¹ż³ĢÖŠ³ĮµķÖŹĮæµÄ±ä»ÆĒéæöČēĶ¼ĖłŹ¾£ŗ²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com