


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
(2)一定量的乙醇在氧气不足时燃烧,得CO2、CO和H2O共
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)有机化合物A、B分子式不同,它们只可能含C、H、O元素中的两种或三种。如果将A、B不论以何种比例混合,只要其物质的量之和不变,完全燃烧时消耗O2和生成H2O的物质的量也不变。那么A、B组成必须满足的条件是______________。若A为CH4,则符合上述条件的B中相对分子质量最小的是______________ (写分子式),并写出相对分子质量最小且含甲基的B的两种同分异构体的结构简式______________、______________。
(2)一定量的乙醇在氧气不足时燃烧,得CO2、CO和H2O共27.6 g,若其中水为10.8 g,则CO的质量为______________。
A.1.4 g B.2.2 g C.4.4 g D.2.2 g和4.4 g之间
查看答案和解析>>
科目:高中化学 来源:2012届北京市西城区高三上学期期末考试化学试卷 题型:填空题
(12分)欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如下图所示。已知:碳酸不能溶解Al(OH)3沉淀。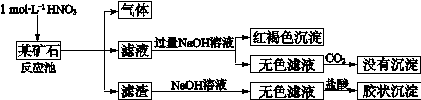
(1)Si在周期表中的位置是 。
(2)下列说法正确的是 。
| a.酸性:H2CO3>H2SiO3 | b.原子半径:O<C<Si<Al |
| c.稳定性:H2O>CH4>SiH4 | d.离子半径:O2-<Al3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com