
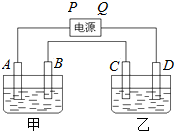
 已知A、B、C、D都是铂电极,P、Q是直流电源的两极,通电后发现B极质量增加.
已知A、B、C、D都是铂电极,P、Q是直流电源的两极,通电后发现B极质量增加.| 100g×2% |
| 58.5g/mol |
| 1.415 |
| 99.635 |


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
| A、在密闭容器中加入1.5molH2和0.5molN2,充分反应后可得NH3分子数目为NA |
| B、足量的铁粉与lmolCl2在加热条件下充分反应,转移的电子数为3NA |
| C、标准状况下,等物质的量的N2和CO所含分子数均为NA |
| D、7.8 g Na2O2中含有的离子总数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
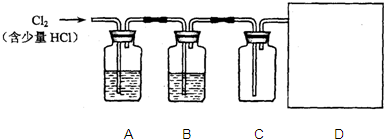
| 实验步骤 | 预期现象和相应结论 | |
| i |  试管B中的试剂为澄清石灰水.向试管A中滴入盐酸. 试管B中的试剂为澄清石灰水.向试管A中滴入盐酸. |
①若 ②若 |
| ii | 若“假设一”不成立,向实验步骤i反应后的试管A中滴入2滴 |
①若 中的②分析,则“假设三”成立. ②若 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
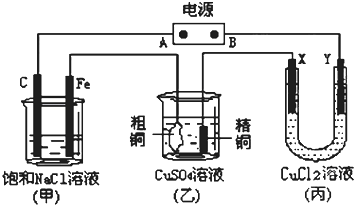
查看答案和解析>>
科目:高中化学 来源: 题型:
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
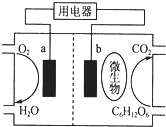 以葡萄糖为燃料的微生物燃料电池结构如图所示.a为电池的正极,关于该电池的叙述正确的是( )
以葡萄糖为燃料的微生物燃料电池结构如图所示.a为电池的正极,关于该电池的叙述正确的是( )| A、该电池能够在高温下工作 |
| B、b电极发生还原反应 |
| C、O2在a电极被氧化 |
| D、电流从a电极经用电器流向b电极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com