
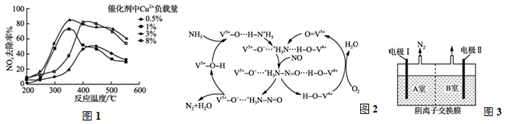
分析 (1)根据图象找出NO去除率最高时对应的温度和催化剂中Cu2+负载量;
(2)①O3氧化NO结合水洗可产生HNO3和O2,结合原子守恒和得失电子守恒写出反应方程式;
②酸性条件下,水在阳极失电子生成臭氧;
(3)①由图3可知反应物为氧气、一氧化氮和氨气最终生成物为氮气和水;
②根据氨气失去的电子的物质的量等于NO和氧气得到的电子总物质的量计算;
(4)①若n(NO):n(NO2)>1:1,则一氧化氮过量,若<1:1,则二氧化氮过量;
②通过A室产生了N2,可知A极的电解质溶液为NaNO3和NaNO2的混合溶液,NO2-在A极放电为N2,则A为阴极;则B极为阳极,电解质溶液为NaOH溶液,OH-在B极放电,据此分析.
解答 解:(1)由图1可知在350℃左右,催化剂中Cu2+负载量为3%时,NO去除率最高;
故答案为:350℃左右、3%;
(2)①O3氧化NO结合水洗可产生HNO3和O2,其反应方程式为:3O3+2NO+H2O═2HNO3+3O2;
故答案为:3O3+2NO+H2O═2HNO3+3O2;
②酸性条件下,水在阳极失电子生成臭氧,生成1mol臭氧转移6mol电子,则电极方程式为:3H2O-6e-═O3↑+6H+;
故答案为:3H2O-6e-═O3↑+6H+;
(3)①由图3可知反应物为氧气、一氧化氮和氨气最终生成物为氮气和水,所以NO最终转化为N2和H2O;
故答案为:N2;
②氧气、一氧化氮和氨气反应生成氮气和水,反应中氨气失去的电子的物质的量等于NO和氧气得到的电子总物质的量,2mol NH3转化为N2失去6mol电子,0.5mol O2得到2mol电子,则NO转化为N2得到的电子为4mol,所以NO的物质的量为2mol,其体积为44.8L;
故答案为:44.8L;
(4)①若n(NO):n(NO2)<1:1,则二氧化氮过量,二氧化氮可与石灰乳反应生成Ca(NO3)2,若n(NO):n(NO2)>1:1,则一氧化氮过量,排放气体中NO含量升高;
故答案为:产品Ca(NO2)2中Ca(NO3)2含量升高;放出的气体中NO含量升高;
②NO2-在阴极得电子被还原为氮气,结合B室的溶液是中性溶液,故放电的方程式为:2NO2-+6e-+4H2O=8OH-+N2↑,
故答案为:2NO2-+6e-+4H2O=8OH-+N2↑.
点评 本题考查了化学方程式的书写、电解原理的应用、氧化还原反应、图象的分析与应用等,考查了学生的分析能力以及对基础知识的综合应用能力,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
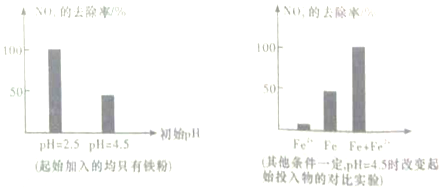
| A. | pH=4.5时,NO3-的去除率低,其原因可能是FeO(OH) 不导电,阻碍电子转移 | |
| B. | 通过对比试验发现,在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率,可能原因是Fe2+将NO3-直接还原了 | |
| C. | 加入Fe2+可能发生的反应是Fe2++2FeO(OH)═Fe3O4+2H+ | |
| D. | 由图猜测,溶液中H+浓度越大,对NO3-的去除率越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液中CO32-水解:CO32-+2H2O?H2CO3+2OH- | |
| B. | Al溶于NaOH溶液:Al+2OH-═AlO2-+H2↑ | |
| C. | Fe3O4溶于稀HNO3:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O | |
| D. | 向Ba(OH)2溶液中加少量稀H2SO4:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 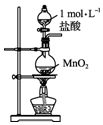 用装置甲制取氯气 | B. |  用装置乙氧化溴离子 | ||
| C. |  用装置丙分离出溴的CCl4溶液 | D. |  用装置丁获得单质溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的裂解、煤的干馏、蛋白质的盐析都是化学变化 | |
| B. | C2H4Cl2、C5H12均只有两种同分异构体 | |
| C. | Na与H2O的反应是熵增的放热反应,该反应能自发进行 | |
| D. | 已知25℃、101kPa,在稀溶液中:H+ (aq)+OH-(aq)=H2O(aq)△H=-57.3kJ/mol.则相同条件下,若将含1molCH3COOH的稀溶液与含1molNaOH的稀溶液混合,放出的热量等于57.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
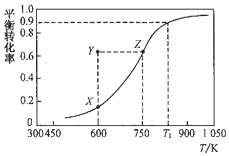 甲醇脱氢可制取甲醛:CH3OH(g)?HCHO(g)+H2(g),甲醇的平衡转化率随温度变化的曲线如图所示(已知反应在IL 的密闭容器中进行).下列有关说法正确的是( )
甲醇脱氢可制取甲醛:CH3OH(g)?HCHO(g)+H2(g),甲醇的平衡转化率随温度变化的曲线如图所示(已知反应在IL 的密闭容器中进行).下列有关说法正确的是( )| A. | 平衡常数:K600K>K750K | |
| B. | 从Y到Z点可通过增大压强实现 | |
| C. | 在Tl点K时,该反应的平衡常数为8.1 | |
| D. | 若工业上利用此反应进行生产,为了提高经济效益将反应温度升高至1050K以上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | 电离常数 | 弱酸 | 电离常数 |
| H2CO3 | Ka1=4.4×10-7 | H2C2O4 | Ka1=5.4×10-2 |
| Ka2=4.7×10-11 | Ka2=5.4×10-5 |
| A. | 2 | B. | 4 | C. | 6 | D. | 8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com