
����Ŀ��һ���¶����п��淴Ӧ��A��g��+2B��g��2C��g��+D��g�����ֽ�5mol A��10mol B����һ���Ϊ2L���ܱ������У���Ӧ��10minʱ�ı�ijһ������C�����ʵ���Ũ����ʱ��仯��ϵ��ͼ��ʾ�������й�˵����ȷ���ǣ� �� 
A.��0��5min�ڣ�����Ӧ����������
B.��Ӧ����ʼ��5minʱ��B��ת����Ϊ50%
C.5minʱ��ƽ�ⳣ����10minʱ��ƽ�ⳣ������
D.��15minʱ��B���������Ϊ25%
���𰸡�B
���������⣺A������ͼ���֪��0��5min��C�����ʵ���Ũ��������˵����Ӧ����������У���Ӧ���Ũ�����ڼ�С����������Ӧ��������С����A���� B��5mol A��10mol B����һ���Ϊ2L���ܱ������У���c��A��=2.5mol/L��c��B��=5mol/L��
A��g��+ | 2B��g�� | 2C��g��+D��g���� | |
��ʼŨ�ȣ�mol/L�� | 2.5 | 5 | 0 |
��Ӧ�仯��Ũ�ȣ�mol/L�� | 1.25 | 2.5 | 2.5 |
ƽ��ʱ��Ũ�ȣ�mol/L�� | cƽ��A�� | cƽ��B�� | 2.5 |
cƽ��B��=2.5mol/L
��B��ת���ʦ�= ![]() ��100%=50%
��100%=50%
��B��ȷ��
C��ƽ�ⳣ��ֻ���¶��йأ����������������أ��������¶�û�б仯�����Ի�ƽ�ⳣ�����䣬��C����
D������ͼ���֪����10min��15minʱ��ƽ��û���ƶ�����15minʱ��B����������͵�10minʱ��һ����
�ڵ�10minʱ��
A��g��+ | 2B��g�� | 2C��g��+ | D��g�� | |
��ʼ���ʵ�����mol�� | 5 | 10 | 0 | 0 |
��Ӧ�仯�����ʵ�����mol�� | 2.5 | 5 | 5 | 2.5 |
ƽ��ʱ�����ʵ�����mol�� | n��A�� | n��B�� | 2.5��2 | 2.5 |
��ƽ��ʱn��A��=2.5mol n��B��=5mol n��C��=5mol n��D��=2.5mol
��B���������= ![]() ��100%=
��100%= ![]() ��100%=33.3%����D����
��100%=33.3%����D����
��ѡB



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѡ��һ�������£�һ�ַ�Ӧ���������һ�ַ�Ӧ���Բ�����ȫ��Ӧ���ǣ� ��
A.�����������뵪��
B.������Ũ�������������
C.������ͭ��Ũ����
D.�������18 mol/L����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ����٤������������˵����ȷ���ǣ� ��
A.22g CO2�к���NA����ԭ��
B.ͨ��״���£�11.2 L�����к���NA����ԭ��
C.2mol��������ϡ���ᷴӦ����3NA����������
D.��״���£�22.4 L H2O�к���NA��ˮ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾΪѪ�쵰�ͼ��쵰�Ļ��Բ��֩���Ѫ���صĽṹʽ�� 
�ش��������⣺
��1��Ѫ�����к���C��H��O��N��Fe����Ԫ�أ�C��N��O����Ԫ�صĵ�һ��������С�����˳���� �� д����̬Feԭ�ӵĺ�������Ų�ʽ ��
��2��Ѫ������Nԭ�ӵ��ӻ���ʽΪ �� ����ͼ�ķ������á��������Fe2+����λ����
��3�����Цġ��á�������ͬ�������壬�þ��徧���������е���ԭ����Ϊ �� �ġ������־�������ԭ�ӵ���λ��֮��Ϊ �� 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ��Ŀ�Ŀ���ʵ�ֻ������ȷ����
A. ��������ƽ��ȡ3.23gNaCl����
B. ��10mL��Ͳ��ȡ7.50mLϡ����
C. ����ʱ�����۹�����ȴˮ�������Ͽڽ��¿ڳ�
D. ϡ��Ũ����ʱ����Ũ��������������ע��ˮ������Ͻ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ʴʱ�������Ϸ����ĵ缫��Ӧ��( )
A. 2H+��2e����H2 B. Fe2+��2e����Fe
C. 2H2O��O2��4e����4OH�� D. Fe3+��e����Fe2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ���ҹ���ѧ�ҽ������ϳɵ����־���Ȳ��������ӵĽṹʽ�� 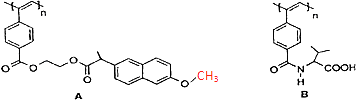
����˵����ȷ���ǣ� ��
A.A��B������һ��������ˮ�⣬��ˮ����������ֲ���
B.Aˮ�����ɵĸ߷��ӻ�����������̼ԭ��һ������
C.A��B�������о�����2����������̼ԭ��
D.1molA��B�����ȼ�Һ��Ӧ�����������2n mol NaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����к�������NaCl�� Na2SO4��Na2CO3�����ʵ�NaNO3��Һ��ѡ���ʵ����Լ���ȥ���ʣ��õ�������NaNO3���壬ʵ����������ͼ��ʾ��
��1������A����Ҫ�ɷ��������ѧʽ����
��2���٢ڢ��о����еķ����������
��3����Һ3�����������Եõ�NaNO3���壬��Һ3�п϶����е������� �� Ϊ�˳�ȥ���ʣ�������Һ3�м�����������
��4��ʵ��̽��С����ʵ������Ҫ�õ�456 mL1 molL-1��HNO3��Һ��������ʵ������ֻ����һƿ8 molL-1��HNO3��Һ����С����8molL-1��HNO3��Һ����������Һ��
��ʵ��������IJ�������������mL��Ͳ���ձ�������ͷ�ιܵȡ�
�ڸ�ʵ������Ҫ��ȡ8molL-1��HNO3��ҺmL��
������ʵ������е������Ƶ���ҺŨ��ƫ�ߵ�����
A.ȡ8molL-1��HNO3��Һ��Һʱ���ӿ̶���
B.��ȡ�õ���Ͳˮϴ��δ�����κβ���
C. 8molL-1��HNO3��Һ����Ͳת�����ձ�����ˮϴ����Ͳ��ȫ��ת�����ձ�
D.����ʱ���ӿ̶���
E.���ݺ�����ƿ��ҡ�Ⱥ���Һ����ڿ̶��ߣ�δ�����κβ���
��5��ijͬѧת����Һ�IJ�����ͼ��ʾ����ͬѧ�����еĴ�����������ƿ�Ŀ̶��߱��ڱȽ�ϸ��ƿ��֮�ϵ�ԭ������
A.Ϊ������ B.Ϊ��ͳһ�� C.Ϊ�����ȷ�� D.����̻�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����÷�����X��ϩ��Y���Ժϳ����������ռ�BAD�� ��֪��G���ܷ���������Ӧ��B��FeCl3��Һ����ɫ��C��D�Ĺ���Ϊ�����Ȼ�����COOH���ķ�Ӧ������BAD�ṹ��ʽΪ�� 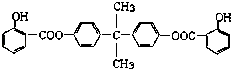
BAD�ĺϳ�·�����£�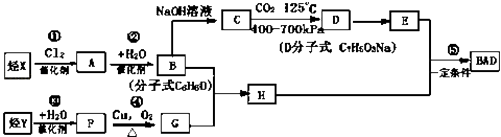
�Իش��������⣺
��1��д���ṹ��ʽYD ��
��2�����ڼӳɷ�Ӧ���У���������ţ� ��
��3��1molBAD�����뺬molNaOH����Һ��ȫ��Ӧ��
��4��д������ʽ��Ӧ�� �� F+E ��
��5��E�ж���ͬ���칹�壬�жϷ�������Ҫ���ͬ���칹����ĿΪ�֣� ���ܷ���������Ӧ����FeCl3��Һ����ɫ�ۺ˴Ź�������ͼ�����ĸ����շ壮
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com