
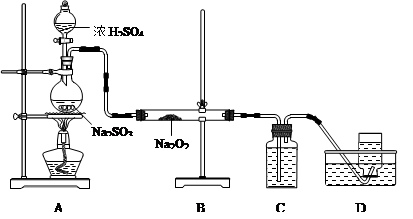
 3SO2↑+ 2H2O
3SO2↑+ 2H2O

 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
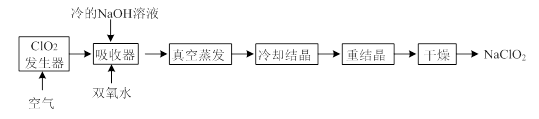
优秀生应用题卡口算天天练系列答案科目:高中化学 来源:不详 题型:实验题
| 分子式 | 外观 | 热分解温度 | 熔点 | 水溶性(20℃) |
| CO(NH2)2·H2O2 | 白色晶体 | 45℃ | 75—85℃ | 500g·L—1 |


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.除去MgCl2酸性溶液中的Fe3+:加热搅拌,加入MgCO3,过滤,加适量的盐酸 |
| B.制备硅酸胶体:向硅酸钠水溶液中逐滴滴加稀盐酸至溶液呈强酸性 |
| C.检验Fe2(SO4)3溶液中是否含有FeSO4:滴加少许酸性高锰酸钾溶液,并振荡 |
| D.使盛有少量氢氧化镁沉淀的试管中的沉淀溶解:加入一定量的氯化铵溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
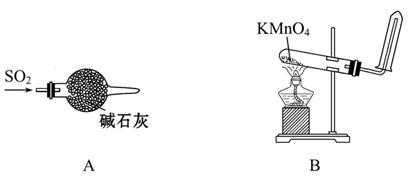
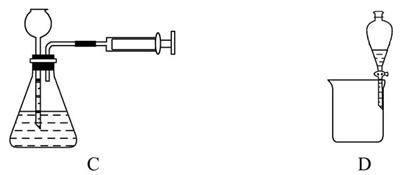
| A.干燥SO2 |
| B.实验室制取并收集O2 |
| C.装置气密性的检查 |
| D.分离乙醇和乙酸的混合液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.某溶液中加入BaCl2溶液,产生白色沉淀,加入HNO3后,沉淀不溶解,则该溶液中一定含有SO42- |
| B.某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中至少有SO32-和CO32-中的一种 |
| C.取少量Na2SO3样品于试管中加水溶解后加入盐酸有气体产生,再加入BaCl2溶液有白色沉淀产生,说明Na2SO3样品已部分被氧化 |
| D.能使湿润的淀粉碘化钾试纸变蓝的一定是Cl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
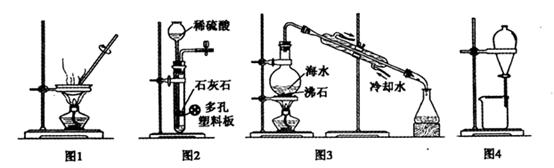
| A.用图1装置蒸干CuCl2饱和溶液制备CuCl2晶体 |
| B.用图2装置制取二氧化碳气体 |
| C.用图3装置蒸馏海水制取少量淡水 |
| D.用图4装置分离乙醇与乙酸乙酯的混合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
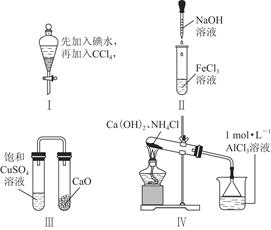
| A.实验Ⅰ:振荡后静置,液体分层,下层液体无色 |
| B.实验Ⅱ:滴入氢氧化钠溶液后,试管中出现白色沉淀,白色沉淀迅速变为灰绿色,最后变为红褐色 |
| C.实验Ⅲ:一段时间后,饱和CuSO4溶液中出现蓝色晶体 |
| D.实验Ⅳ:加热后,水槽中先生成白色沉淀,后逐渐溶解 |
查看答案和解析>>
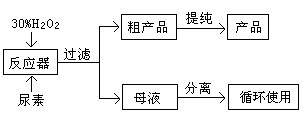
科目:高中化学 来源:不详 题型:实验题
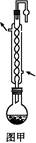
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 物质 | 杂质 | 试剂 | 主要操作 |
| A | NaHCO3固体 | Na2CO3固体 | / | 加热 |
| B | SiO2 | Fe2O3 | 盐酸 | 过滤 |
| C | KBr溶液 | Br2 | KOH溶液 | 分液 |
| D | Cl2 | HCl | 饱和碳酸钠溶液 | 洗气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com