
| y |
| 2 |
| x |
| y |
| 1 |
| 4 |
| 1 |
| 4 |


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
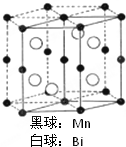 磁光盘机(Magnetic Optical Disk Drive,MO)是一种可重写的光盘驱动器,它使用磁光盘片作存储媒体.磁光存储的研究是Williams等在1957年使Mn和Bi形成的晶体薄膜磁化并用光读取之后开始的.如图是该物质的晶体结构,其化学式可表示为( )
磁光盘机(Magnetic Optical Disk Drive,MO)是一种可重写的光盘驱动器,它使用磁光盘片作存储媒体.磁光存储的研究是Williams等在1957年使Mn和Bi形成的晶体薄膜磁化并用光读取之后开始的.如图是该物质的晶体结构,其化学式可表示为( )| A、Mn2Bi |
| B、MnBi |
| C、MnBi3 |
| D、Mn4Bi3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
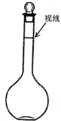 实验室需用230mL 0.1mol/L的Na2CO3溶液,填空并回答下列问题:
实验室需用230mL 0.1mol/L的Na2CO3溶液,填空并回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)t℃时水的离子积为1×10-13,则该温度(选填大于、小于或等于)
(1)t℃时水的离子积为1×10-13,则该温度(选填大于、小于或等于)查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2X | 187 | 202 | 2.6 |
| H2Y2 | 272 | 423 | 以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com