
| A. | 氮气 | B. | 硫化氢 | C. | 氨气 | D. | 氮的氧化物 |
分析 高污染车排出的尾气中所含的污染物除碳氢化合物、可吸入颗粒物、一氧化碳外,还有车辆发动时氮气与氧气反应生成的氮的氧化物,氮的氧化物为空气污染物,以此来解答.
解答 解:A.氮气是空气的组成成分之一,不是污染物,不会引起污染,故A错误;
B.汽车尾气为高温条件下的产物,硫化氢和氧气在高温下反应生成二氧化硫和水,所以尾气中不可能含有硫化氢,故B错误;
C.放电以及高温下不可能生成氨气,应生成氮的氧化物,氨气不存在于汽车尾气中,故C错误;
D.车辆发动时氮气与氧气反应生成的氮的氧化物,氮的氧化物为空气污染物,故D正确.
故选D.
点评 本题是考查空气污染原因和污染物的种类,为高频考点,侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,题目比较简单,主要考查了汽车尾气的成分,我们要从源头上控制破坏环境的行为,树立环境保护的意识.


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案科目:高中化学 来源: 题型:解答题
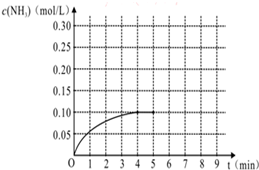 在一容积为4L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g )△H<0,反应中NH3的物质的量浓度变化情况如图:
在一容积为4L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g )△H<0,反应中NH3的物质的量浓度变化情况如图:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W<X<Y<Z | |
| B. | 简单氢化物的稳定性X>Y>Z | |
| C. | W、X、Y形成的化合物抑制水的电离 | |
| D. | m的分解产物中p为氧化产物,q为还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | I | II | III | IV | Ⅴ |
| 样品质量(g) | 3.06 | 6.12 | 9.18 | 12.24 | 15.30 |
| Ba(OH)2溶液体积(mL) | 300 | 300 | 300 | 300 | 300 |
| 生成沉淀的质量(g) | 5.91 | 11.82 | 17.73 | 23.64 | 23.64 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(NH4+)>c(Cl-)>c(H+)>c(OH-) | B. | c(NH4+)>c(Cl-)>c(OH-)>c(H+) | ||
| C. | c(Cl-)>c(NH4+)>c(H+)>c(OH-) | D. | c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | H2O/mL | 温度/℃ | KMnO4溶液完全褪色时间(s) | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | 体积/mL | ||||
| ① | 0.20 | 2.0 | 0.010 | 4.0 | 2.0 | 25 | t1 |
| ② | 0.20 | 4.0 | 0.010 | 4.0 | 0 | 25 | t2 |
| ③ | 0.20 | 4.0 | 0.010 | 4.0 | 0 | 50 | t3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | N2O4和NO2的分子数比为1:2 | |
| B. | N2O4和NO2的浓度相等 | |
| C. | 体系的颜色不再改变 | |
| D. | 单位时间内有1molN2O4转化为NO2的同时,有2molNO2转化为N2O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①>②>③>④ | B. | ①=②=③=④ | C. | ①=②=③>④ | D. | ①>②>③=④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com