
【题目】工业上电解制碱的技术是用离子交换膜法。请回答下列问题:
(1)电解精制食盐水,电解槽中的阳离子交换膜把电解槽隔成了阴极室和阳极室,它只允许阳离子通过,而不允许_____________(填离子符号)和气体通过。
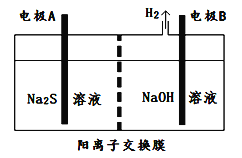
(2)氯碱工业中获得的烧碱可以吸收有毒气体H2S,吸收后的溶液加入到如图所示的电解池的阳极区进行电解以获取单质硫。
①Na2S溶液显碱性的原因(离子方程式):____________________________________________________________。
②电极A应该与直流电源的____________相连。A电极反应为________________________________________________。
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节电、节能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出。
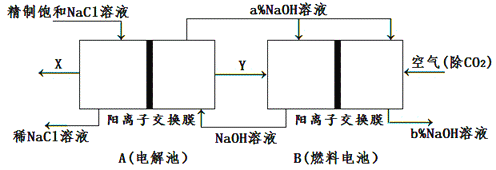
①图示中电极产物X、Y分别是____________、____________(填化学式)。图示中氢氧化钠溶液质量分数大小:a%______b%(填“﹥”“﹤”或“=”)。
②燃料电池B中正极的电极反应:_________________________________________________________。
【答案】 Cl- OH- S2-+H2O![]() HS-+OH- 正极 S2--2e-=S Cl2 H2 ﹤ O2+4e-+2H2O=4OH-
HS-+OH- 正极 S2--2e-=S Cl2 H2 ﹤ O2+4e-+2H2O=4OH-
【解析】试题分析:(1)阳离子交换膜只允许阳离子通过,而不允许阴离子、气体通过;(2)①Na2S是强碱弱酸盐,S2-水解;②S2-在A极失电子生成S单质;(3)①根据阳离子交换膜的作用和燃料电池的工作原理来回答;②根据燃料电池的工作原理来回答;
解析:(1)阳离子交换膜只允许阳离子通过,而不允许阴离子Cl- 、OH-和气体通过;(2)①Na2S是强碱弱酸盐,S2-水解溶液呈碱性,水解方程式是S2-+H2O![]() HS-+OH-;②S2-在A极失电子生成S单质,所以A应该与直流电源的正极相连,电极反应式为S2--2e-=S;(3)(3)①在燃料电池中,氧气作正极,所以通入空气的极是正极,通入燃料的极是负极,所以Y是氢气,即产生Y的极是阴极,产生X的电极是阳极,阳极氯离子失电子生成氯气,X是氯气;燃料电池的正极是氧气得电子在碱性条件下生成氢氧根离子,钠离子通过阳离子膜进入正极区生成氢氧化钠,所以氢氧化钠浓度增大,a%<b%;②燃料电池的正极是氧气得电子在碱性条件下生成氢氧根离子,电极反应式是O2+4e-+2H2O=4OH-;
HS-+OH-;②S2-在A极失电子生成S单质,所以A应该与直流电源的正极相连,电极反应式为S2--2e-=S;(3)(3)①在燃料电池中,氧气作正极,所以通入空气的极是正极,通入燃料的极是负极,所以Y是氢气,即产生Y的极是阴极,产生X的电极是阳极,阳极氯离子失电子生成氯气,X是氯气;燃料电池的正极是氧气得电子在碱性条件下生成氢氧根离子,钠离子通过阳离子膜进入正极区生成氢氧化钠,所以氢氧化钠浓度增大,a%<b%;②燃料电池的正极是氧气得电子在碱性条件下生成氢氧根离子,电极反应式是O2+4e-+2H2O=4OH-;


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 凡是能溶于水有甜味的物质都属于糖类 B. 糖类都能发生水解反应
C. 油脂、糖类都属于高分子化合物 D. 葡萄糖属于单糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和肼(N2H4)都是氮元素的重要氢化物,在工农业生产、生活中有广泛应用。
(1)工业中常用以下反应合成氨:N2+3H2![]() 2NH3 △H<0。某实验室在三个不同条件的密闭容器中,分别加入浓度均为c(N2)=0.100mol/L,c(H2)=0.300mol/L进行反应时,N2的浓度随时间的变化如下图①、②、③曲线所示:
2NH3 △H<0。某实验室在三个不同条件的密闭容器中,分别加入浓度均为c(N2)=0.100mol/L,c(H2)=0.300mol/L进行反应时,N2的浓度随时间的变化如下图①、②、③曲线所示:
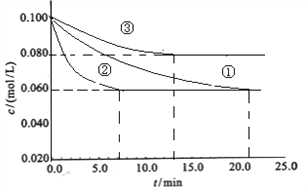
装罝③仅有一个反应条件与①不同,该条件为_______________,实验②平衡时H2的转化率为_____________;
(2)肼是一种具有强还原性的无色油状液体,可用作燃料。
①在火箭推进器中装有胼(N2H4)和液态H2O2,已知0.4mol液态N2H4和足量液态H2O2反应,生成气态N2和气态H2O,放出256.6kJ的热量。该反应的热化学方程式为_____________________________________________________。
②肼(N2H4)-空气燃料电池是一种环保型碱性燃料电池,电解质溶液是20%-30%的KOH溶液。已知肼在101kPa、25℃条件下的燃烧热为624kJ·mol-1,如果此燃料电池的能量转化率为50%,当消耗空气2.24L(已折算为标准状况下体积)时,则此电池产生的电能约为_________kJ。(假设空气中氧气的体积含量为20%,产物为液态水)

(3)肼又称“联氨”,为二元弱碱,在水中的电离方程式与氨相似,肼第一步电离反应的平衡常数值为____________.(已知:N2H4+H+![]() N2H5+ 的K=8.7×107;KW =1.0×10-14)
N2H5+ 的K=8.7×107;KW =1.0×10-14)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某重要有机合成中间体X的结构如图所示,有关该物质的说法正确的是

A. X分子中所有碳原子一定共面
B. X可以使溴水、酸性KMnO4褪色,且原理不相同
C. 标况下1 molX分别和足量Na和NaHCO3反应,生成气体体积相同
D. X与庚二酸(![]() )互为同分异构体
)互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有KI、NaBr的混合溶液中通入过量的Cl2充分反应.将溶液蒸干并灼烧,最后剩余的固体物质是( )
A.KI和NaBr
B.KCl和NaCl
C.KCl和NaBr
D.KCl、NaCl和I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NaOH标准溶液滴定未知浓度的盐酸,用酚酞为指示剂,造成测定结果偏高的原因可能是
A. 配制标准溶液的NaOH中混有Na2CO3 杂质
B. 盛装待测液的锥形瓶用燕馏水洗过,没有用待测液洗
C. 滴定到终点读数时,俯视刻度线
D. 滴定到终点读数时,滴定管尖嘴处有气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)①H2 + CuO ![]() Cu + H2O
Cu + H2O
②CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
③3S + 6NaOH ![]() 2Na2S + Na2SO3 + 3H2O
2Na2S + Na2SO3 + 3H2O
④NH4NO3 + Zn = ZnO + N2↑+ 2H2O
⑤Cu2O + 4HCl = 2HCuCl2 + H2O
上述反应中,属于氧化还原反应的是__________________________(填序号)
(2)SeO2、KI和HNO3可发生反应:SeO2+KI+HNO3→Se+I2+KNO3+H2O,配平该反应的化学方程式并用双线桥法标出电子转移的方向和数目:____________________________。
(3)在反应 KIO3 + 6HI = 3I2 + KI + 3H2O中,氧化剂与还原剂的物质的量之比为__________。
Ⅱ.已知:
① 2H2O + Cl2 + SO2 = H2SO4 + 2HCl ② 2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
(4)根据以上两个反应可以得出氧化剂和还原剂的强弱顺序,请写出由KMnO4、K2SO4 、MnSO4 、SO2、H2O、H2SO4 这六种物质组成的氧化还原反应的方程式并配平:_______________________。
在反应②中,若有18.25g HCl被氧化,求:
(5)转移的电子数为:_______________。
(6)标况下生成Cl2的体积(请列式计算)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋资源应用非常广泛,从中可提取氯化钠、碘等化工产品。回答下列问题:
I.实验室用氯化钠固体配制1.0molL-1的食盐水500mL。
(1)所需仪器为容量瓶(规格为____)、托盘天平、烧杯、玻璃棒和_____。
(2)配制时,下列操作对所配溶液的浓度有何影响?(填字母)无影响的有_____,偏大的有______,偏小的有_______。
A.称量时使用了生锈的砝码
B.往容量瓶中移液时,有少量液体溅出
C.容量瓶未干燥即用来配制溶液
(3)若加蒸馏水定容时不慎超过了刻度线,应如何处理?_______
II.海藻中含有丰富的碘元素,某课外活动小组欲从海藻中提取碘(已知过程②中反应的离子方程式为2I—+C12=2C1—+I2),设计如下的流程:

(4)指出提取碘的过程中有关实验操作的名称:①_______,③______。
(5)提取碘的过程中,可选择的有机溶剂是______。
A.酒精 B.醋酸 C.苯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com