
| A. | ②④⑤ | B. | ①④⑤ | C. | ①⑤ | D. | ①③ |
 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:选择题
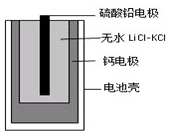 热激活电池可用作火箭、导弹的工作电池.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池的总反应方程式为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb.
热激活电池可用作火箭、导弹的工作电池.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池的总反应方程式为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb.| A. | 正极反应式:Ca+2Cl--2e-=CaCl2 | |
| B. | 放电过程中,Li+向钙电极移动 | |
| C. | 外电路中,电子由硫酸铅电极经导线流向钙电极 | |
| D. | 常温时,在正负极间接上电流表或检流计,指针不偏转 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通常状况下的气体摩尔体积约为22.4L | |
| B. | 标准状况下的气体摩尔体积约为22.4L | |
| C. | 相同物质的量的气体气体摩尔体积相同 | |
| D. | 同温同压的气体气体摩尔体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16O2与18O2互为同分异构体 | |
| B. | 16O与18O核外电子排布方式不同 | |
| C. | 通过化学变化可以实现16O与18O间的相互转化 | |
| D. | 等质量的H218O和D216O含有的电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性(酸性溶液):HCl>CoCl2>HI | B. | 酸性(水溶液):CH3COOH>HCN>H2CO3 | ||
| C. | 热稳定性:KCl<KClO4<KClO | D. | 氧化性(酸性溶液):Co(OH)3>FeCl3>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一维SiC纳米棒“比表面积”大,对微小粒子有较强的吸附能力 | |
| B. | 上述反应中SiC既是氧化产物又是还原产物 | |
| C. | SiCl4是由极性键构成的非极性分子 | |
| D. | 每生成1mol SiC转移8mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 理论解释 |
| A | H2S的沸点比H2O的高 | H2S的范德华力大于H2O的范德华力 |
| B | 第一电离能Mg>Al | Mg的3P轨道处于全空状态,能量低,越稳定 |
| C | 熔点Na<Al | 同为金属晶体,Al原子半径小,外围电子多,晶格能大 |
| D | 键的极性:H-O>N-H | 非金属性差异越大,键的极性越小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
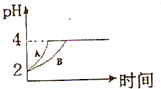 现有室温下浓度均为1×10-3mol/L的几种溶液:①盐酸、②醋酸、③氨水、④NaOH溶液,回答下列问题:
现有室温下浓度均为1×10-3mol/L的几种溶液:①盐酸、②醋酸、③氨水、④NaOH溶液,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com