
【题目】CO和H2均是重要的化工原料,CO2的固定和利用对环境保护及能源开发具有重要的意义。
(1)利用水煤气(CO+H2)作为合成气,在同一容器中,选择双催化剂,经过如下三步反应,最终合成二甲醚(CH3OCH3)。
甲醇合成反应:CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.8kJ·mol-1
CH3OH(g) △H1=-90.8kJ·mol-1
水煤气变换反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2=-41.3kJ·mol-1
CO2(g)+H2(g) △H2=-41.3kJ·mol-1
甲醇脱水反应:2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H3=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) △H3=-23.5kJ·mol-1
写出由CO和H2合成二甲醚气体和水蒸气的热化学方程式____________。
(2)在2L恒容密闭容器中,投入CO(g)和H2(g)各5mol,发生如下反应:
3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g) △H<0,CO的转化率α与温度、压强的关系如图所示:
CH3OCH3(g)+CO2(g) △H<0,CO的转化率α与温度、压强的关系如图所示:

①p1、p2、p3中最大的是________。
②若该反应进行50min时达到平衡,此时CO的转化率α=0.6,则50min内H2的反应速率为____mol·L-1·min-1。
(3)二甲醚(CH3OCH3)燃料电池具有启动快。效率高等优点,其能量密度高于甲醇燃料电池。其工作原理如图所示。X极附近的酸性______(填“减弱”、“增强”或“不变”),Y电极是_____极,写出X电极上发生的电极反应式__________。若用该二甲醚燃料电池电解饱和食盐水(阳极为石墨电极),当有2.3g燃料被消耗时,阴极产生气体的体积为_____L(标准状况下)

【答案】 )2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g) △H=-205.1kJ·mol-1 p1 0.03 增强 正极 CH3OCH3-12e-+3H2O=2CO2↑+12H+ 6.72
CH3OCH3(g)+H2O(g) △H=-205.1kJ·mol-1 p1 0.03 增强 正极 CH3OCH3-12e-+3H2O=2CO2↑+12H+ 6.72
【解析】(1)①CO(g)+2H2(g)═CH3OH(g)△H1=-90.8kJmol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g)△H2=-23.5kJmol-1
依据盖斯定律①×2+②得到:2CO(g)+4H2(g)=CH3OCH3+H2O(g)△H=(-90.8kJmol-1)×2+(-23.5kJmol-1)=-205.1kJmol-1;
(2)①3CO(g)+3H2(g)═CH3OCH3(g)+CO2(g),可知正反应为气体体积减小的反应,所以增大压强,平衡正向移动,一氧化碳的转化率提高,因此压强关系是p1<p2<p3,即压强最大的是p3;
②反应3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g) 进行50min时达到平衡,此时CO的转化率α=0.6,则变化的CO为3mol,变化的H2也为3mol,H2的反应速率为
CH3OCH3(g)+CO2(g) 进行50min时达到平衡,此时CO的转化率α=0.6,则变化的CO为3mol,变化的H2也为3mol,H2的反应速率为![]() =0.03mol·L-1·min-1。
=0.03mol·L-1·min-1。
(3)③电池在放电过程中,电极X发生的电极反应为(CH3)2O-12e-+3H2O=2CO2+12H+,X电极周围溶液的酸性增强;c处通入的气体是氧气,发生还原反应,则Y极为正极;当有2.3g燃料被消耗时,被氧化的二甲醚的物质的量为2.3g÷46g/mol=0.05mol,转移电子的物质的量为0.05mol×12=0.6mol,电解饱和食盐水(阳极为石墨电极),阴极产生氢气的体积为![]() ×22.4L/mol=6.72。
×22.4L/mol=6.72。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.若丙醇中的氧为188O,它与乙酸反应生成的酯的相对分子质量是104
B.用乙酰水杨酸![]() 与适量NaOH溶液反应制备
与适量NaOH溶液反应制备![]()
C.向柠檬醛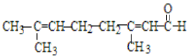 中加入酸性高锰酸钾,若溶液褪色,说明分子中含有醛基
中加入酸性高锰酸钾,若溶液褪色,说明分子中含有醛基
D.![]() 、
、![]() 、
、![]() 三种氨基酸脱水,最多可生成 6种二肽。
三种氨基酸脱水,最多可生成 6种二肽。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关环境保护与绿色化学的叙述不正确的是( )
A.形成酸雨的主要物质是硫的氧化物和氮的氧化物
B.大气污染物主要来自化石燃料燃烧和工业生产过程产生的废气
C.绿色化学的核心就是如何对被污染的环境进行无毒无害的治理
D.水华、赤潮等水体污染主要是由含氮、磷的生活污水任意排放造成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可充电电池的原理如图所示,已知a、b为惰性电极,溶液呈酸性。充电时右槽溶液颜色由绿色变为紫色。下列叙述正确的是

A. 放电时,H+从左槽迁移进右槽
B. 放电过程中,左槽溶液颜色由黄色变为蓝色
C. 充电时,b极接直流电源正极,a极接直流电源负极
D. 充电过程中,a极的电极反应式为:VO2++2H++e- = VO2++H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的气化主要反应是煤中碳与水蒸气反应生成CO、H2等。回答下列问题:
(1)CO与H2分别与O2都可以设计成燃料电池。CO与O2设计成燃料电池(以熔融碳酸盐为电解质)负极的电极反应为:______________;
(2)在煤的气化获得的化工原料气中含有少量羰基硫(COS),能引起催化剂中毒、大气污染等。COS的电子式为___________;羰基硫与烧碱溶液反应生成水喝两种正盐的离子方程式为:__________;羰基硫的脱硫常用两种方法,其反应式分别为:
①氢解反应:COS(g) + H2(g) = H2S(g) + CO(g) ΔH1=+7kJ/mol
②水解反应:COS(g) + H2O(g) = H2S(g) + CO2(g) ΔH2
已知反应中相关的化学键键能数据如下:
化学键 | C=O(CO2) | C=O(COS) | C=S | H-S | H-O |
键能(kJ/mol) | 803 | 742 | 577 | 339 | 465 |
则ΔH2=____________kJ/mol。
(3)脱硫处理后的CO和H2在催化剂作用下合成甲醇:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH2=-90.14kJ/mol。该反应能自发的理由是_______
CH3OH(g)+H2O(g) ΔH2=-90.14kJ/mol。该反应能自发的理由是_______
①一定温度下,在两个容积都为为VL的恒容莫比容器中,按如下方式加入反应物,一段时间后达到平衡:
容器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | a molCO2、3a molH2、 n molCH3OH(g)、n molH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则n的取值范围为_____________;
②甲容器保持恒容,欲增大H2的平衡转化率,可采取的措施有:________(答两点即可)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com