


分析 (1)不产生其它物质的反应原子的利用率最高;
(2)根据双氧水和转移电子之间的关系式计算;SO42-失去e-生成S2O82-;
(3)减小气压,使液体沸点降低;
(4)根据图片中曲线变化趋势与溶液粘度、反应速率之间的关系分析.
解答 解:(1)ABC中除了生成双氧水为还有其它物质生成,D中只有双氧水生成,所以D中原子利用率最高,故答案为:D;
(2)该反应中氧元素的化合价变化为:-2价→-1价,所以生成1mol双氧水转移电子2NA;SO42-失去e-生成S2O82-,阳极的电极反应方程是:2SO42--2e-=S2O82-,故答案为:2NA;2SO42--2e-=S2O82-;
(3)过氧化氢受热容易分解,减小气压,使液体沸点降低;残液为NH4HSO4,可循环利用,故答案为:过氧化氢不稳定,受热容易分解,减小气压,使液体沸点降低;NH4HSO4;
(4)根据图2知,纵坐标越大其粘度越大,相同时间内纵坐标变化越大,其反应速率越快,根据图3知,相同浓度的铜离子溶液中,纵坐标变化越大,其反应速率越大,
A.e曲线变化不明显,所以锰离子能使该降解反应速率减缓,故正确;
B.相同时间内,含有亚铁离子的曲线纵坐标变化比含有铜离子的大,所以亚铁离子对该降解反应的催化效率比铜离子高,故错误;
C.海藻酸钠浓度与溶液粘度正相关,粘度变化越大海藻酸钠浓度变化越大,其反应速率越大,所以海藻酸钠溶液粘度的变化快慢可反映出其降解反应速率的快慢,故正确;
D.根据图3知,一定条件下,铜离子浓度一定时,反应时间越长,溶液粘度越小,则海藻酸钠溶液浓度越小,故正确;
故答案为:B.
点评 本题考查较综合,涉及电极反应式的书写、原子利用率等知识点,难点是图象分析,会采用“定一议二”的方法分析图象,难度较大.


科目:高中化学 来源: 题型:解答题
| 化学键 | Cl-Cl | PCl3中P-Cl键 | PCl5中P-Cl键 |
| 键能/kJ•mol-1 | d | 1.2c | c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,已知两瓶容积相同,同温同压下,左瓶内充满氯化氢气体,当右瓶中充满下列混合气体中的某一组时,其所含原子总数与左瓶中所含原子总数一定相等,则该混合气体是( )
如图所示,已知两瓶容积相同,同温同压下,左瓶内充满氯化氢气体,当右瓶中充满下列混合气体中的某一组时,其所含原子总数与左瓶中所含原子总数一定相等,则该混合气体是( )| A. | O3、N2 | B. | CH4、NH3 | C. | N2、O2 | D. | CO、CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | ||
| Y | ||
| Z |
 ,该分子中含2个σ键,0个π键(若不含填0).
,该分子中含2个σ键,0个π键(若不含填0).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 2:l | C. | 3:2 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若已知上述反应为放热反应,升高温度,其平衡常数减小 | |
| B. | 上述反应中每生成1molSi3N4,转移12mol电子 | |
| C. | 在氮化硅的合成反应中,N2是氧化剂,SiO2是还原剂 | |
| D. | 若使压强增大,上述平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
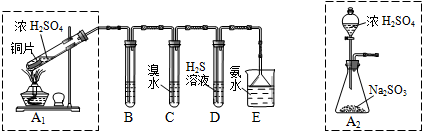
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取l mol/L BaCl2溶液向小烧杯滴加直至过量. | 若出现白色浑浊,则溶液中存在SO32-或 SO42-. |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体滴入1滴品红,再滴入过量2 mol/L盐酸,振荡 用试管取适量滤液,向其中滴入过量l mol/LBa(OH)2溶液(或1滴品红,再滴入2-3滴2 mol/L盐酸),振荡. 步骤3: | 若品红褪色(或有气泡)则存在SO32- 若出现白色沉淀(或品红褪色或有气泡),则存在HSO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com