
����Ŀ���������Ƴ�����Ư����ɱ��������������ˮ�Ͷ�����̼�����ʷ�����Ӧ�����治�����ױ��ʡ�ij��ȤС���Թ�������Ϊ�����������̽����
̽��һ�� �������CO2������Na2O2��Ӧ���͡�CO2����ˮ����ʱ������Na2O2��Ӧ�����������ʵ��װ�ã�
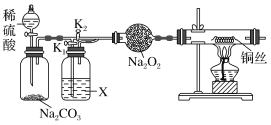
(1)����װ�ã���������ԡ��ڸ������װ��Na2O2��������ϡ���ᣬ����CO2����K1���ر�K2��һ��ʱ����ټ���ͭ˿�����У�X��Ӧ�����Լ�_____________(������)����ͨһ��ʱ��CO2��Ŀ����____________________________________��ʵ��۲쵽ͭ˿δ�仯����ó����ۡ������CO2������Na2O2��Ӧ����
(2)����K2���ر�K1������_____________________________����֤������ˮʱCO2��Na2O2��Ӧ��������O2��
̽������Na2O2�Ƿ��Ѿ����ʲ����Բⶨ����Ʒ��Na2O2����������
(3)��ͬѧΪ���Բⶨ����Ʒ��Na2O2��������������ȡm g��Ʒ���������װ�ý���ʵ�飺
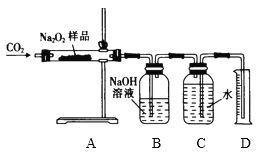
ʵ�鿪ʼ��A�з�����Ӧ�Ļ�ѧ����ʽΪ��______________________________������װ��B��ȥ�������δ��Ӧ��CO2������װ��C��D��Һ��߶���ͬ��������ͲD��ˮ����������������������������Ϊn g�������Ʒ��Na2O2����������Ϊ��____________________________��
���𰸡�Ũ���� ��װ���ڵ������ų�����ֹ����ͭ��Ӧ����ʵ�� ͭ˿�ɺ��� 2 Na2O2��2 CO2=2 Na2CO3��O2�� ![]()
��������
(1)Ҫ֤�������CO2������Na2O2��Ӧ���Լ�XӦ�Ǹ������װ���к��п�������������ʵ�飻
(2) ����K2���ر�K1���������̼�����к���ˮ������
(3) A�й��������������̼��Ӧ����̼���ƺ����������ݷ�Ӧ����ʽ����������Ƶ�������
(1)Ҫ֤�������CO2������Na2O2��Ӧ���Լ�XӦ�Ǹ��������X��Ũ���װ���к��п�������������ʵ�飬������ͨһ��ʱ��CO2��Ŀ���ǣ���װ���ڵ������ų�����ֹ����ͭ��Ӧ����ʵ�飻
(2) ����K2���ر�K1���������̼�����к���ˮ��������ͭ˿�ɺ��ڣ�֤������ˮʱCO2��Na2O2��Ӧ��������O2��
(3) A�й��������������̼��Ӧ����̼���ƺ���������Ӧ����ʽ��2Na2O2��2CO2=2 Na2CO3��O2����
����Ʒ��Na2O2��������xg��
2Na2O2��2CO2=2 Na2CO3��O2��
156 32
xg ng
![]() ��n=
��n=![]() g��
g��
����Ʒ��Na2O2����������Ϊ![]() g��m g��100%=
g��m g��100%=![]() ��
��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����º��������·�����Ӧ��N2(g)��3H2(g)![]() 2NH3(g)������1 mol������3 mol���������ܱ������У���Ӧ��ƽ��ʱ���������������Ϊa��������ͬ���������ܱ������зֱ�����������ʣ� ��Ӧ��ƽ��ʱ���������������������Ϊa����
2NH3(g)������1 mol������3 mol���������ܱ������У���Ӧ��ƽ��ʱ���������������Ϊa��������ͬ���������ܱ������зֱ�����������ʣ� ��Ӧ��ƽ��ʱ���������������������Ϊa����
A. 2 mol NH3B. 1 mol N2��3 mol H2��2 mol NH3
C. 0.5 mol N2��1.5 mol H2��1 mol NH3D. 0.1 mol N2��0.3 mol H2��1.8 mol NH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯�������ճ�����������Ӧ�ù㷺���о������仯�����Ӧ�������ش�
��1��������Ԫ�ص�����ֻ�л�ԭ����___��
A��Fe B��FeCl2 C��FeCl3 D��Fe2O3
��2��������ȱ��ʱ��������Ҫ�Բ�������Ʒ�������ܹ����յ���+2�۵���������+2�۵��������ױ�������
����μ���ij���岹��������Ԫ���ѱ�������д���������̡������ۡ���___��
�ڷ���ά����C����ʹʳ���е�����������ת��Ϊ���������ӡ��ɴ˿���֪��ά����C����___���ѧ���ʣ���
��3��������أ�K2FeO4����һ�����͡���Ч�������ɫˮ��������ʪ���Ʊ�������أ�K2FeO4���ķ�Ӧ��ϵ������������Fe(OH)3��C1O-��OH-��FeO42-��Cl-��H2O��д������ƽʪ���Ƹ�����ص����ӷ�Ӧ����ʽ��__Fe(OH)3+__ClO-+__=__FeO42-+__Cl-+___
��4����ҵ�����Ȼ�����ʴͭ���������·�塣ij����ʦΪ�˴�ʹ�ù��ĸ�ʴ��Һ�л���ͭ��������Ȼ������壬���������в��裺
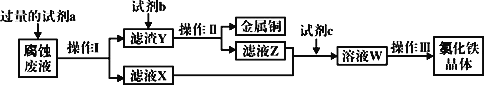
�ش��������⣺
���Լ�a��___������I�õ��IJ����������ձ�����������___��
����ҺX��Z�ж���ͬһ�����ʣ�����ת��Ϊ��ҺW�����ӷ���ʽΪ___��
��д��FeCl3��Һ�����ͭ������Ӧ�����ӷ���ʽ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����A�IJ���ͨ����������һ�����ҵ�ʯ�ͻ���ˮƽ����2CH3CHO��O2![]() 2CH3COOH������AΪ��Ҫԭ�Ϻϳɻ�����E����ϳ�·����ͼ1��ʾ���ش��������⣺
2CH3COOH������AΪ��Ҫԭ�Ϻϳɻ�����E����ϳ�·����ͼ1��ʾ���ش��������⣺

��1��д���������ʵĹ��������ƣ�B��____________________��D��____________________��
��2����Ӧ�ܵĻ�ѧ����ʽΪ________________________________________________����Ӧ���ͣ�________��
��3��ijѧϰС���������B��������ʵ��װ�����£�����ͼ2װ�ûش����⡣

��װ�ü���ƿ��ʢ�ŵĹ���ҩƷ����Ϊ________(����ĸ)��
A��Na2O2 B��KClC��Na2CO3 D��MnO2
��ʵ������У���װ��Ӳ�ʲ������з�����Ӧ�Ļ�ѧ����ʽΪ_______________________________��
������B�Ĵ����������������Ǿ�����ͬ��������Ӧ�������õ���������μӵ�����������ͭ����Һ�м��ȣ�����Ϊ______________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ֲ���纣���ͺ����к��зḻ�ĵ�Ԫ�أ���Ԫ���Ե����ӵ���ʽ���ڡ�ʵ������Ӻ�������ȡ����������£�
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() �D��
�D��![]()
ij��ѧ��ȤС�齫�������̢�������Ƴ�����ͼ��ʾ������

��֪���̢ڷ�����Ӧ�Ļ�ѧ����ʽΪCl2��2KI===2KCl��I2
�ش��������⣺
��1��д����ȡ���̢�������ʵ����������ƣ���____________����____________��
��2�������չ����У�ʹ�õ���ʵ�������оƾ��ơ�____________��____________(����������)��
��3��F���²�Һ�����ɫΪ________ɫ���ϲ�Һ�������ʵ���Ҫ�ɷ�Ϊ____________��
��4����F�еõ���̬�����еIJ�����_______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʼ�����������˰����ӵ�����(NA=6.02214076��1023mol1)������2019��5��20����ʽ��Ч�������й�NA˵����ȷ����
A. 22.4LCH2=CH2CH3�����к�̼̼˫������ĿΪNA
B. 17g�ǻ�����OH�������ĵ�������Ϊ9NA
C. 64 g S2��S8������к���ԭ������ΪNA
D. 1L0.5mol��L1FeCl3��Һ��Cl-��ĿС��1.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijһ��Ӧ��ϵ���з�Ӧ��������ﹲ�������ʣ�O2��H2CrO4��Cr (OH)3��H2O��H2O2�� ��֪�÷�Ӧ��H2O2ֻ�������¹��̣�H2O2��O2
(1)�÷�Ӧ�еĻ�ԭ����______________��
(2)�÷�Ӧ�У�������ԭ��Ӧ�Ĺ�����________��________��
(3)д���÷�Ӧ�Ļ�ѧ����ʽ�����õ����ű������ת�Ƶķ������Ŀ��__________��
(4)�練Ӧת����0.3 mol���ӣ�������������ڱ�״�������Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�����������ʵ�飬�����õ����к������������ø�������������գ�
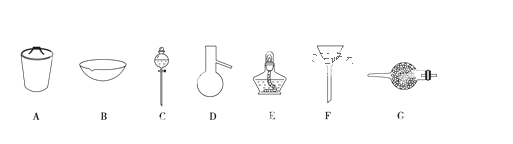
��������NH3��ʹ������_____��
�������뻥�����ܵ�����Һ̬���ʣ���ʹ��_____��
��������Һ̬������зе㲻ͬ����֣���ʹ��_____��
�������븡��Һ���еĹ������ʣ���ʹ��_____��
��2�����ʵķ����ǻ�ѧ�о��г��õķ�������д�������ʷ���ʱ��ʹ�õķ�����������������ϸ�ڣ���
�������Һ��ķ���_____��
�����������ʵ���Һ�г�ȥ�����ܼ�_____��
�����ַе����ϴ�Ļ���Һ��ķ���_____��
����������������ˮ���ܽ�ȵIJ�ͬ���ᴿ���ʣ�_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����к�������NaCl�� Na2SO4��Na2CO3�����ʵ�NaNO3��Һ��ѡ���ʵ����Լ���ȥ���ʣ��õ�������NaNO3���壬ʵ����������ͼ��ʾ��
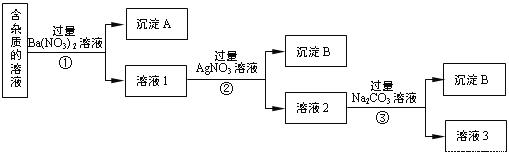
(1)����A����Ҫ�ɷ���_____________��______________���ѧʽ����
(2)�٢ڢ��о����еķ��������_______________��
(3)��Һ3�����������Եõ�NaNO3���壬��Һ3�п϶����е�������__________��Ϊ�˳�ȥ���ʣ�������Һ3�м���������______________��
(4)ʵ��̽��С����ʵ������Ҫ�õ�456 mL1 molL-1��HNO3��Һ��������ʵ������ֻ����һƿ8 molL-1��HNO3��Һ����С����8molL-1��HNO3��Һ����������Һ��
��ʵ��������IJ�����������________��_____mL��Ͳ���ձ���________����ͷ�ιܵȡ�
����ʵ������Ҫ��ȡ8molL-1��HNO3��Һ________mL��
������ʵ������е������Ƶ���ҺŨ��ƫ�ߵ���_____________��
A.ȡ��8molL-1��HNO3��Һ��Һʱ������Ͳ�̶���
B.��ȡ�õ���Ͳˮϴ��δ�����κβ���
C.8molL-1��HNO3��Һ����Ͳת�����ձ�����ˮϴ����Ͳ��ȫ��ת�����ձ�
D.����ʱ���ӿ̶���
E.���ݺ�����ƿ��ҡ�Ⱥ���Һ����ڿ̶��ߣ�δ�����κβ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com