
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c1 | 0.2 | pH=7 |
| 丙 | 0.1 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
分析 (1)酸碱的物质的量相等,如为强酸,反应后溶液呈中性,如为弱酸,反应后溶液呈酸性;
(2)从HA的强弱以及溶液电中性的角度分析;
(3)HA为一元酸,反应生成NaA,溶液显示碱性,则HA为弱酸;根据物料守恒解答.
解答 解:(1)一元酸HA和NaOH溶液等体积混合,两种溶液的物质的量浓度都为0.2mol/L,则酸碱的物质的量相等,若a=7,说明反应后溶液呈中性,则HA是强酸,如a>7,反应后呈碱性,则HA是弱酸,
故答案为:若a=7,HA为强酸;若a>7,HA为弱酸;
(2)反应后溶液呈中性,如HA为强酸,则c=0.2,如HA为弱酸,则c>0.2,仅从乙组情况分析,c不一定等于0.2,
由于反应后溶液呈中性,则有c(OH-)=c(H+),根据溶液呈中性,则有c(Na+)+c(H+)=c(A-)+c(OH-),所以c(A-)=c(Na+),
故答案为:否;C;
(3)根据丙中数据可知,浓度相同的HA与氢氧化钠溶液反应恰好生成NaA,溶液的pH=9,溶液呈碱性,则生成的NaA为强碱弱酸盐,说明HA为弱酸;根据溶液中的物料守恒可得:c(A-)+c(HA)=c(Na+)=0.05 mol/L,
故答案为:弱酸;c(Na+)或0.05 mol/L.
点评 本题考查酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确弱电解质的电离和盐类水解原理为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的分析能力及灵活应用能力.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:解答题
| 容器编号 | 实验条件 | 平衡时反应中的能量变化 |
| Ⅰ | 恒温恒容 | 放热Q1kJ |
| Ⅱ | 恒温恒压 | 放热Q2kJ |
| Ⅲ | 恒容绝热 | 放热Q3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
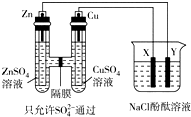 按如图所示装置连接,X、Y均为惰性电极.常温下,当Zn极质量减少3.25g时,X极生成气体840mL(标准状况),若此时烧杯中溶液的体积为500mL,则此时烧杯中溶液的pH(不考虑生成气体溶于水及与溶液的反应)( )
按如图所示装置连接,X、Y均为惰性电极.常温下,当Zn极质量减少3.25g时,X极生成气体840mL(标准状况),若此时烧杯中溶液的体积为500mL,则此时烧杯中溶液的pH(不考虑生成气体溶于水及与溶液的反应)( )| A. | 11 | B. | 12 | C. | 13 | D. | 14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlON和石英的化学键类型相同 | |
| B. | AlON和石英晶体类型相同 | |
| C. | AlON中N元素的化合价为-1 | |
| D. | 电解熔融AlON或电解熔融Al2O3都能得到Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁的冶炼过程是通过置换反应得到单质铁 | |
| B. | 太阳能电池可采用硅材料制作,其应用有利于环保、节能 | |
| C. | 化学家采用玛瑙研钵磨擦固体反应物进行溶剂合成,玛瑙的主要成分是硅酸盐 | |
| D. | 包装食品里常有硅胶、生石灰、还原铁粉三类小包,其作用相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
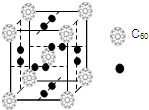 科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体.该物质中K原子和C60分子的个数比为3:1.
科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体.该物质中K原子和C60分子的个数比为3:1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ①③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
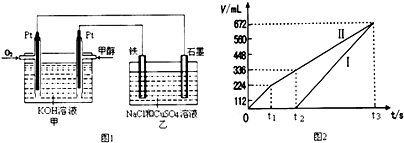
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不慎碰倒酒精灯,洒出的酒精在桌上燃烧时,应立即用湿抹布扑盖 | |
| B. | 不慎将浓硫酸溅到皮肤上,应先用布抹去,再用大量水冲洗,最后涂上碳酸氢钠溶液 | |
| C. | 制取蒸馏水时,为防止烧瓶内产生暴沸现象,应先向烧瓶中加入几片碎瓷片 | |
| D. | 实验室制取氧气完毕后,应停止加热,再取出集气瓶,最后取出导气管 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com