
| A. | 煤、石油、天然气都是化石能源 | |
| B. | 氢能、核能都是无污染的可再生能源 | |
| C. | 氢能是可再生能源 | |
| D. | 化石能源是非再生能源 |
分析 A、化石能源是指由远古时代的动植物在地壳中经过几亿年转化而来的燃料;
B、核能有放射性;
C、氢能来自于水,燃烧后又生成水;
D、化石能源是由远古时代的动植物在地壳中经过几亿年转化而来的.
解答 解:A、化石能源是指由远古时代的动植物在地壳中经过几亿年转化而来的燃料,包括石油、煤和天然气,故A正确;
B、核能有放射性,不是无污染的,故B错误;
C、氢能来自于水,燃烧后又生成水,故是可以再生的能源,故C正确;
D、化石能源是由远古时代的动植物在地壳中经过几亿年转化而来的,短期内不可再生,故是非再生能源,故D正确.
故选B.
点评 本题考查了化石燃料以及可再生能源,应注意的是化石能源是由远古时代的动植物在地壳中经过几亿年转化而来的,短期内不可再生.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:解答题
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2使溴水褪色,显示了SO2的漂白性 | |
| B. | SO2使溴水褪色,显示了SO2的还原性 | |
| C. | 从溴水中提取单质溴,可以用乙醇进行萃取 | |
| D. | SO2是形成酸雨的唯一污染物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
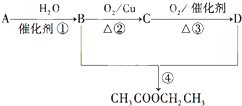 已知:
已知: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N5+共有34个核外电子 | B. | N5+中氮原子间以共价键结合 | ||
| C. | 化合物N5ASF6中AS的化合价为+1价 | D. | 化合物N5ASF6中F的化合价为-1价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
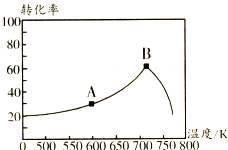 碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题.消除汽车尾气中的NO、CO,有利于减少PM2.5的排放.已知如下信息:
碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题.消除汽车尾气中的NO、CO,有利于减少PM2.5的排放.已知如下信息:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4、3、6 | B. | 4、3、5 | C. | 2、5、4 | D. | 4、6、4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com