
| A. | 聚乙烯是无毒高分子化合物,可用作食品包装 | |
| B. | 人体内的蛋白质不断分解,最终生成水和二氧化碳排出体外 | |
| C. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 | |
| D. | 电子垃圾的回收利用,可减少对土壤和水源的污染 |
分析 A.聚乙烯无毒;
B.人体内的蛋白质不断分解,最终以尿素的形式排出体外;
C.地沟油属于油脂,油脂可发生皂化反应制肥皂;
D.电子产品里含有很多砷、镉、铅等重金属.
解答 解:A.聚乙烯无毒,可用作食品包装,故A正确;
B.人体内的蛋白质不断分解,最终以尿素的形式排出体外,蛋白质不能转化为二氧化碳,故B错误;
C.地沟油经过皂化反应制肥皂,与甲醇在催化剂作用下进行酯交换制成生物柴油,故C正确;
D.电子产品里含有很多砷、镉、铅等重金属,还含有难降解的有毒物质,电子垃圾的回收利用,可减少对土壤和水源的污染,故D正确;
故选B.
点评 本题考查合成材料、蛋白质在人体中的代谢产物、常见生活环境的污染,题目难度不大,注意常见物质的应用和性质,注重相关基础知识的积累.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 磷单质及其化合物有广泛应用.
磷单质及其化合物有广泛应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纸层析法中的展开剂之所以能够展开的主要原理是毛细现象 | |
| B. | 在中和滴定实验中,既可用标准溶液滴定待测液,也可用待测液滴定标准溶液 | |
| C. | 实验中需用2.0 mol•L-1的Na2 CO3溶液950 mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分别为950mL,201.4g | |
| D. | 减压过滤的原理是抽气泵给吸滤瓶减压,造成吸滤瓶内与布氏漏斗液面上的压力差,从而加快过滤速度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 键 | H-H | N-H | N-N | N=N | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 159 | 418 | 945 |
| 分子式 | 结构简式 | 熔点 | 沸点 | 水溶性 | |
| 乙醇 | C2H6O | C2H5OH | -114.3℃ | 78.4°C | 互溶 |
| 二甲醚 | C2H6O | CH3OCH3 | -138.5℃ | -24.9℃ | 微溶 |
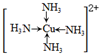 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com