
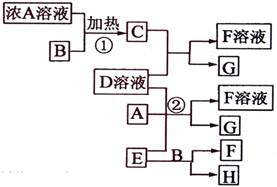
(9分)有关物质存在如图所示的转化关系(部分产物已省略)。通常C为气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。
![]()
![]()
![]()
请回答下列问题
(1)反应①的化学方程式为
(2)反应②的离子方程式为
(3)写出另外一种实验室制取H的化学方程式
(4)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp=7.0×10―9。将等体积的D溶液与Pb(NO3)2溶液混合,若D的浓度为1×10―2mo1/L ,则生成沉淀所需Pb(NO3)2溶液的最小浓度为 。
(1)反应①的方程式:4HCl(浓) + MnO2 ![]() MnCl2 + Cl2↑ + 2H2O
MnCl2 + Cl2↑ + 2H2O
(2)反应②的离子方程式:6I-+ ClO3- + 6H+ = 3I2+Cl- + 3H2O
(3)2H2O2![]() 2H2O + O2↑(也可用高锰酸钾加热分解)
2H2O + O2↑(也可用高锰酸钾加热分解)
(4)D溶液与Pb(NO3)2 反应生成沉淀为PbI2 ,PbI2![]() Pb2+ + 2I-
Pb2+ + 2I-
Ksp= c(Pb2+)?c(I-)2 = c(Pb(NO3)2 ) ÷2 ?(10-2÷2)2= 7.0×10-9
所以c(Pb(NO3)2 ) = 5.6×10-4 mol?L-1
解析:首先得破框图,G为紫黑色固体单质,一般可预测为碘单质,可推得C物质为氯气,则A为盐酸、B为二氧化锰;E在二氧化锰的催化下制取H,则E为氯酸钾、H为氧气;F为氯化钾;于是D一定为碘化钾。所以推出A盐酸、B二氧化锰、C氯气、D碘化钾、E氯酸钾、F氯化钾、G碘、H氧气。


科目:高中化学 来源: 题型:阅读理解
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩。
(1)基态砷原子的电子排布式为 ▲ ;砷与溴的第一电离能较大的是 ▲ 。
(2)AsH3是无色稍有大蒜味气体。AsH3的沸点高于PH3,其主要原因是 ▲ 。
(3)Na3AsO4可作杀虫剂。AsO43-的空间构型为 ▲ ,与其互为等电子体的一种分子为 ▲ 。
(4)某砷的氧化物俗称“砒霜”,其分子结构如右图所示。该化合物的分子式为 ▲ ,As原子采取 ▲ 杂化。
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaAs晶体中,每个As与 ▲ 个Ga相连,As与Ga之间存在的化学键有 ▲ (填字母)。
A.离子键 B.σ键 C.π键 D.氢键 E.配位键 F.金属键 G.极性键
B.某研究小组以苯甲醛为原料,制备苯甲酸和苯甲醇。反应原理如下:

有关物质的部分物理性质如下:
|
| 熔点/℃ | 沸点/℃ | 溶解性 |
| 苯甲醛 | —26 | 179 | 微溶于水,易溶于乙醇、乙醚 |
| 苯甲酸 | 122 | 249 | 微溶于水,易溶于乙醇、乙醚 |
| 苯甲醇 | -15.3 | 205.0 | 稍溶于水,易溶于乙醇、乙醚 |
| 乙醚 | -116.2 | 34.5 | 微溶于水,易溶于乙醇 |
实验步骤:
(1)在250 mL锥形瓶中,放入9 g KOH和9 mL水,配成溶液,冷却至室温。加入10.5 g新蒸馏的苯甲醛,塞紧瓶塞,用力振荡,使之变成糊状物,放置24 h。
①苯甲醛要求新蒸馏的,否则会使 ▲ (填物质名称)的产量相对减少。
②用力振荡的目的是 ▲ 。
(2)分离苯甲醇
①向锥形瓶中加入30 mL水,搅拌,使之完全溶解。冷却后倒入分液漏斗中,用30 mL乙醚萃取苯甲醇(注意留好水层)。30 mL 乙醚分三次萃取的效果比一次萃取的效果 ▲ (填“好”或“差”)。
②将醚层依次用饱和亚硫酸氢钠溶液、饱和碳酸钠溶液和水各5 mL洗涤,再用无水硫酸镁干燥。将干燥后的乙醚溶液转移到100 mL蒸馏烧瓶中,投入沸石,连接好普通蒸馏装置,加热蒸馏并回收乙醚,应选择的加热方法是 ▲ (填字母代号)。
A.水浴加热 B.油浴加热 C.沙浴加热 D.用酒精灯直接加热
③改用空气冷凝管蒸馏,收集 ▲ ℃的馏分。
(3)制备苯甲酸
在乙醚萃取过的水溶液中,边搅拌边加入浓盐酸酸化至pH=3.5左右。冷却使结晶完全,抽滤,洗涤、干燥。抽滤完毕或中途停止抽滤时,应先 ▲ 。
查看答案和解析>>
科目:高中化学 来源:2012届江苏省南京市四校高三12月月考化学试卷 题型:填空题
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩。
(1)基态砷原子的电子排布式为 ▲ ;砷与溴的第一电离能较大的是 ▲ 。
(2)AsH3是无色稍有大蒜味气体。AsH3的沸点高于PH3,其主要原因是 ▲ 。
(3)Na3AsO4可作杀虫剂。AsO43-的空间构型为 ▲ ,与其互为等电子体的一种分子为 ▲ 。
(4)某砷的氧化物俗称“砒霜”,其分子结构如右图所示。该化合物的分子式为 ▲ ,As原子采取 ▲ 杂化。
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaAs晶体中,每个As与 ▲ 个Ga相连,As与Ga之间存在的化学键有 ▲ (填字母)。
A.离子键 B.σ键 C.π键  D.氢键 E.配位键 F.金属键 G.极性键
D.氢键 E.配位键 F.金属键 G.极性键
B.某研究小组以苯甲醛为原料,制备苯甲酸和苯甲醇。反应原理如下:
有关物质的部分物理性质如下:
| | 熔点/℃ | 沸点/℃ | 溶解性 |
| 苯甲醛 | —26 | 179 | 微溶于水,易溶于乙醇、乙醚 |
| 苯甲酸 | 122 | 249 | 微溶于水,易溶于乙醇、乙醚 |
| 苯甲醇 | -15.3 | 205.0 | 稍溶于水,易溶于乙醇、乙醚 |
| 乙醚 | -116.2 | 34.5 | 微溶于水,易溶于乙醇 |
 萃取的效果 ▲ (填“好”或“差”)。
萃取的效果 ▲ (填“好”或“差”)。 馏装置,加热蒸馏并回收乙醚,应选择的加热方法是 ▲ (填字母代
馏装置,加热蒸馏并回收乙醚,应选择的加热方法是 ▲ (填字母代 号)。
号)。 冷却使结晶完全,抽滤,洗涤、干燥。抽滤完毕或中途停止抽滤时,应先 ▲ 。
冷却使结晶完全,抽滤,洗涤、干燥。抽滤完毕或中途停止抽滤时,应先 ▲ 。查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省南京市四校高三12月月考化学试卷 题型:填空题
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩。
(1)基态砷原子的电子排布式为 ▲ ;砷与溴的第一电离能较大的是 ▲ 。
(2)AsH3是无色稍有大蒜味气体。AsH3的沸点高于PH3,其主要原因是 ▲ 。
(3)Na3AsO4可作杀虫剂。AsO43-的空间构型为 ▲ ,与其互为等电子体的一种分子为 ▲ 。

(4)某砷的氧化物俗称“砒霜”,其分子结构如右图所示。该化合物的分子式为 ▲ ,As原子采取 ▲ 杂化。
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaAs晶体中,每个As与 ▲ 个Ga相连,As与Ga之间存在的化学键有 ▲ (填字母)。
A.离子键 B.σ键 C.π键 D.氢键 E.配位键 F.金属键 G.极性键
B.某研究小组以苯甲醛为原料,制备苯甲酸和苯甲醇。反应原理如下:

有关物质的部分物理性质如下:
|
|
熔点/℃ |
沸点/℃ |
溶解性 |
|
苯甲醛 |
—26 |
179 |
微溶于水,易溶于乙醇、乙醚 |
|
苯甲酸 |
122 |
249 |
微溶于水,易溶于乙醇、乙醚 |
|
苯甲醇 |
-15.3 |
205.0 |
稍溶于水,易溶于乙醇、乙醚 |
|
乙醚 |
-116.2 |
34.5 |
微溶于水,易溶于乙醇 |
实验步骤:
(1)在250 mL锥形瓶中,放入9 g KOH和9 mL水,配成溶液,冷却至室温。加入10.5 g新蒸馏的苯甲醛,塞紧瓶塞,用力振荡,使之变成糊状物,放置24 h。
①苯甲醛要求新蒸馏的,否则会使 ▲ (填物质名称)的产量相对减少。
②用力振荡的目的是 ▲ 。
(2)分离苯甲醇
①向锥形瓶中加入30 mL水,搅拌,使之完全溶解。冷却后倒入分液漏斗中,用30 mL乙醚萃取苯甲醇(注意留好水层)。30 mL 乙醚分三次萃取的效果比一次萃取的效果 ▲ (填“好”或“差”)。
②将醚层依次用饱和亚硫酸氢钠溶液、饱和碳酸钠溶液和水各5 mL洗涤,再用无水硫酸镁干燥。将干燥后的乙醚溶液转移到100 mL蒸馏烧瓶中,投入沸石,连接好普通蒸馏装置,加热蒸馏并回收乙醚,应选择的加热方法是 ▲ (填字母代号)。
A.水浴加热 B.油浴加热 C.沙浴加热 D.用酒精灯直接加热
③改用空气冷凝管蒸馏,收集 ▲ ℃的馏分。
(3)制备苯甲酸
在乙醚萃取过的水溶液中,边搅拌边加入浓盐酸酸化至pH=3.5左右。冷却使结晶完全,抽滤,洗涤、干燥。抽滤完毕或中途停止抽滤时,应先 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
科学的发展有一个不断深化的过程。人们对有机化合物的认识同样是这样。
(1)1828年,德国化学家武勒(F?WOhler)冲破了生命力学说的束缚,在实验室里将无机物氰酸铵(NH4CNO)溶液蒸发,得到了有机物尿素[CO(NH2)2]。
|
互为同分异构体的是

|
它不能解释下列 事实
(填入编号)
a.苯不能使溴水褪色
b.苯能与H2 发生加成反应
c.溴苯没有同分异构体
d.邻二溴苯只有一种
将苯与浓硫酸和硝酸混合共热并保存50℃―60℃的温度,可以生成硝基苯。反应后的仪器中有硝基苯、苯和残酸,为得到纯净的硝基苯,要进行中和、水洗,其目的是 ;已知苯的沸点是80℃,硝基苯的沸点是210.9℃,将苯与基苯分离开的实验操作是 。
(3)糖类又称碳水化合物,这是因为过去发现的糖类太多可以用通式Cn(H2O)m来表示。实际上很多符合通式为Cn(H2O)m的化合物并不属于糖类,写出两种符合通式Cn(H2O)m而不属于糖类的有机化合物的结构简式 。
(4)1830年,德国化学家李比希发展了碳、氢分析法,为有机化合物的定量分析打下了基础。某含C、H、O三种元素的未知物,经燃烧实验测定该未知物中碳的质量分数为52.16%,氢的质量分数为13.14%,则A的分子式为 。
A为有关物质存在如下转化关系,B是当今世界产量最大的塑料,广泛用于食品、医药、衣物、化肥等的包装。
![]()
写出下列反应化学方程式
①
。
② 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com