
| A�� | 0.1 mol/L ���������Һ�У�c��NH4+����c��SO42?����c��H+����c��OH?�� | |
| B�� | 0.2mol/LNaHCO3��Һ��0.1mol/LNaOH��Һ�������ϣ�c��H+���Tc��OH?��+c��HCO3?��+2c��H2CO3�� | |
| C�� | pH֮��Ϊ14��H2C2O4��KOH ��Һ��ϣ�c��K+����c��H+����c��OH?����c��HC2O4?�� | |
| D�� | pH=5 ��H2S��Һ�У�c��H+����c��HS?��=1��10-5mol/L |
���� A�������Ϊǿ�������Σ���Һ�����ԣ���NH4+ˮ��̶Ƚ�С��
B.0.2mol/LNaHCO3��Һ��0.1mol/LNaOH��Һ�������ϣ��õ�NaHCO3��Na2CO3�Ļ����Һ��
C��pH֮��Ϊ14��H2C2O4��KOH ��Һ������Һ�е�c��H+���Tc��OH?������H2C2O4Ϊ���ᣬH2C2O4������
D��H2SΪ��Ԫ���ᣬ�����������룮
��� �⣺A�������Ϊǿ�������Σ���Һ�����ԣ���NH4+ˮ��̶Ƚ�С������Һ�д���c��NH4+����c��SO42?����c��H+����c��OH?������A��ȷ��
B.0.2mol/LNaHCO3��Һ��0.1mol/LNaOH��Һ�������ϣ��õ�NaHCO3��Na2CO3�Ļ����Һ����Һ�ʼ��ԣ���c��HCO3?����c��H+������B����
C��pH֮��Ϊ14��H2C2O4��KOH ��Һ������Һ�е�c��H+���Tc��OH?������H2C2O4Ϊ���ᣬH2C2O4������ӦΪc��HC2O4?����c��H+����c��OH?������C����
D��H2SΪ��Ԫ���ᣬ�����������룬c��HS?����1��10-5mol/L����D����
��ѡA��
���� ���⿼������Ũ�ȵĴ�С�Ƚϣ�Ϊ��Ƶ����ͳ������ͣ��Ƕ�֪ʶ���ۺ����ã���Ҫѧ���߱���ʵ�Ļ���֪ʶ������֪ʶ�������⡢����������������Ŀ�ѶȽϴ�ע�����������ʵĵ��롢�����ˮ���Լ�Ũ�ȱȽϵĽǶȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2-�һ����� | B�� | 2-�һ�-1-��ϩ | C�� | 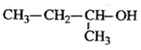 2-��-1-���� | D�� | 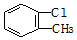 ���ȼױ� ���ȼױ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | �������ˮ���Ʊ������ɱ�ϩ�������ڼ��ȣ�500�棩��Ӧ�Ƶ�һ�ȱ�ϩ | |
| B�� | �ɼױ������ƶ������ױ����ɼױ������Ʊ����� | |
| C�� | ���ȴ���������ȥ�ƻ���ϩ���ɱ�ϩ������1��2-������� | |
| D�� | ��������Ҵ��������������ɱ���������ˮ���Ʊ�������Ҵ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | װ�â٣���ȡ��Ȳ����֤Ȳ�������ʣ���ˮ��ɫ | |
| B�� | װ�âڣ������Ҵ��������ԣ���Һ��ɫ����ɫ��ɳ�ɫ | |
| C�� | װ�âۣ���֤�����Ƿ����к���ȩ�������ţ��������� | |
| D�� | װ�âܣ���֤̼������Աȱ��ӵ�����ǿ����Һ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ܢݢ��� | B�� | �ڢۢޢߢ� | C�� | �ڢۢޢ� | D�� | �ܢݢ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 �Ը����Ϊԭ�ϣ��绯ѧ���Ʊ��ظ���ص�ʵ��װ��ʾ��ͼ��ͼ������˵������ȷ���ǣ�������
�Ը����Ϊԭ�ϣ��绯ѧ���Ʊ��ظ���ص�ʵ��װ��ʾ��ͼ��ͼ������˵������ȷ���ǣ�������| A�� | �������ң������ĵ缫��ӦΪ��2H2O+2e-�T2OH-+H2�� | |
| B�� | �������ң�ͨ������ɻ�ɫ��Ϊ��ɫ������Ϊ����ȡH+Ũ������ʹƽ��2CrO42-+2H+?Cr2O72-+H2O�����ƶ� | |
| C�� | ���Ʊ������ܷ�Ӧ�Ļ�ѧ����ʽΪ��4K2CrO4+4H2O$\frac{\underline{\;ͨ��\;}}{\;}$2K2Cr2O7+4KOH+2H2��+O2�� | |
| D�� | ͨ�������ӽ���Ĥ��������Ҫ��H+���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | n��Cl2����n��Fe��=5��4 5Cl2+4Fe$\frac{\underline{\;��ȼ\;}}{\;}$2FeCl2+2FeCl3 | |
| B�� | n��Cl2����n��FeBr2��=1��1 Fe2++2Br-+Cl2=Fe3++Br2+2Cl- | |
| C�� | n��MnO4-����n��H2O2��=2��3 2MnO4-+3H2O2+6H+=2Mn2++4O2��+6H2O | |
| D�� | n��Fe����n[HNO3��ϡ��]=1��3 4Fe+12H++3NO3-�T3Fe2++Fe3++3NO��+6H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��MgCl2��AlCl3�Ļ��Һ�У���μ���NaOH��Һֱ�����������ⶨ�������NaOH�����ʵ�����mol�������ó��������ʵ�����mol���Ĺ�ϵ��ͼ��ʾ��
��MgCl2��AlCl3�Ļ��Һ�У���μ���NaOH��Һֱ�����������ⶨ�������NaOH�����ʵ�����mol�������ó��������ʵ�����mol���Ĺ�ϵ��ͼ��ʾ���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com