
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
分析 (1)化学平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比,但不包含固体和纯液体;升高温度平衡向吸热方向移动;
(2)可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变以及引起的一系列物理量不变;
(3)先计算浓度商,根据浓度商与化学平衡常数相对大小判断反应进行方向;
(4)根据化学平衡常数计算参加反应的CO物质的量,转化率=$\frac{参加反应的n(CO)}{初始n(CO)}$×100%.
解答 解:(1)化学平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比,但不包含固体和纯液体,所以该反应化学平衡常数K=$\frac{c(C{O}_{2}).c({H}_{2})}{c(CO).c({H}_{2}O)}$;升高温度平衡向吸热方向移动,根据表中数据知,升高温度化学平衡常数减小,说明平衡逆向移动,则正反应是放热反应,
故答案为:$\frac{c(C{O}_{2}).c({H}_{2})}{c(CO).c({H}_{2}O)}$;放热;
(2)A.该反应前后气体物质的量不变,所以反应是否达到平衡状态容器中压强都不变,所以不能判断平衡状态,故错误;
B.混合气体中c(CO)不变时,正逆反应速率相等,反应达到平衡状态,故正确;
C.v逆(H2)=v正(H2O)=v正(H2),正逆反应速率相等,反应达到平衡状态,故正确;
D.c(CO2)=c(CO)时该反应可能达到平衡状态也可能没有达到平衡状态,与反应物初始量及转化率有关,所以不能判断平衡状态,故错误;
故选BC;
(3)因为该反应中各气体计量数都是1,所以化学平衡常数也等于生成物物质的量之积与反应物物质的量之积的比,830℃时,化学平衡常数K=1.0,若该容器中含有1molCO2、1.2molH2、0.75molCO、1.5molH2O,该体系中浓度商=$\frac{1mol×1.2mol}{0.75mol×1.5mol}$=1.07>1,该反应没有达到平衡状态,要使反应达到平衡状态,应该向逆反应方向移动,
故答案为:否;向逆反应方向;
(4)该温度下化学平衡常数K为1.0,设参加反应的n(CO)=xmol,根据方程式知,参加反应的n(H2O)=n(H2)=n(CO2)=n(CO)=xmol,K=$\frac{x.x}{(1-x).(5-x)}$,x=$\frac{5}{6}$
转化率=$\frac{参加反应的n(CO)}{初始n(CO)}$×100%=$\frac{\frac{5}{6}mol}{1mol}×100%$=.83.3%(或83%,或5/6),
故答案为:83.3%(或83%,或5/6).
点评 本题考查化学平衡常数及其有关计算,侧重考查学生对基本概念的理解及化学计算的掌握,明确化学平衡状态判断方法及化学平衡计算中三段式的运用是解本题关键,会根据浓度商与化学平衡常数相对大小判断反应方向,题目难度不大.


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:选择题
| A. | 在化学反应过程中,发生物质变化的同时一定发生能量变化 | |
| B. | 破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量时,反应为吸热反应 | |
| C. | 反应产物的总焓大于反应物的总焓时,反应吸热,△H>0 | |
| D. | 热化学方程式中反应热数值的大小与化学方程式的计量数成比例 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol羟基与1 mol氢氧根离子所含的电子数均为9NA | |
| B. | 常温下,44 g N2O和CO2组成的混合气体,所含原子数为3NA | |
| C. | 0.1 mol/L的NaClO溶液,含有的阴离子数为0.1NA | |
| D. | 常温下,将 1 mol Fe投入过量浓硝酸中,转移的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
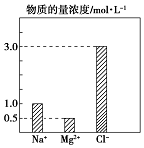 某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有Fe3+、Ba2+、H+、SO42-、CO32-.为了进一步确认,对该溶液进行实验检测:
某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有Fe3+、Ba2+、H+、SO42-、CO32-.为了进一步确认,对该溶液进行实验检测:| 实验操作与现象 | 实验结论 | 判断理由 | |
| 步骤一 | 仔细观察坐标图 | 肯定无 CO32- | 肯定无该离子的理由碳酸根离子和镁离子之间会反应 |
| 步骤二 | 该溶液呈无色、透明、均一状态 | 肯定无 Fe3+ | 肯定无该离子的理由该离子为黄色 |
| 步骤三 | 加入足量BaCl2溶液,生成23.3g白色沉淀,再加稀硝酸,沉淀不消失 | 肯定有SO42-、H+;肯定无Ba2+ | 肯定有H+的理由电荷守恒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag+、Cu2+、NO3-、Na+ | B. | NO3-、Fe3+、Mg2+、SO42- | ||
| C. | Na+、Ca2+、Cl-、CO32- | D. | K+、Ba2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在托盘天平的两个托盘上各放一张大小一样的纸,然后将NaOH固体放在纸上进行称量 | |
| B. | 把称量的NaOH固体放入盛有适量蒸馏水的烧杯中,溶解后立即把溶液转移到容量瓶中 | |
| C. | 用蒸馏水洗涤烧杯、玻璃棒2~3次,每次洗涤后的溶液都注入容量瓶中 | |
| D. | 沿着玻璃棒往容量瓶中加入蒸馏水,直到溶液凹液面恰好与刻度相切 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com