
����Ŀ����������ȵ���Ƭ��ͭƬ�õ�����������500mL����ͭ��Һ�й�����ͼ1��װ�ã�
�����¾����跴Ӧ��������Һ������䣩��
��1����Ƭ�ϵĵ缫��ӦʽΪ______________��ͭƬ��Χ��Һ�����___________������
��2����2 min������Ƭ��ͭƬ֮���������Ϊ1.2g�����㣺�����������ĵ��ӵ����ʵ���Ϊ_________________mo1��
��3�������ĵ绯ѧ��ʴ�ı������γ���ԭ��ء�����ͼ��ʾ���ձ��ж�ʢ��ϡ���ᡣ


��ͼ2 B�е�SnΪ________����Sn��������Һ��pH��������С�䣩___________��
��ͼ2 C�б���ʴ�Ľ�����___________���Ƚ�A��B��C�д�������ʴ�������ɿ쵽����˳����______��
��4������Ӧ��ԭ���ԭ�������˶��ֵ�أ������㲻ͬ����Ҫ��ȼ�ϵ����һ�ָ�Ч�������ѺõĹ���װ�ã���ͼ�ǵ����Ϊϡ������Һ������ȼ�ϵ��ԭ��ʾ��ͼ���ش��������⣺

������ȼ�ϵ�ص��ܷ�Ӧ��ѧ����ʽ�ǣ�___________________��
����ع���һ��ʱ���������Һ��Ũ��_____________������������������С����������������
���𰸡� Fe-2e-=Fe2+ ��Һ��ɫ��dz 0.02 �� ��� п��Zn�� BAC 2H2+O2=2H2O ��С
����������1�����Ľ�����ǿ��ͭ�����Ǹ������缫��ӦʽΪ Fe-2e-=Fe2+��ͭ����������Һ�е�ͭ�������ӷŵ磬ͭ����Ũ�ȼ�С�����ʵ����������Һ��ɫ��dz����2������ͭ���ã���Ϊԭ��صĸ��������ӴӸ�����������ת��xmol���ӣ�������0.5xmolFe������0.5xmolCu������0.5x����64+56��=1.2��x=0.02����3����ͼ2 B�е�Sn�Ľ�������������SnΪ��������Һ�������ӷŵ磬������Ũ�ȼ�С����Sn��������Һ��pH�����A������ѧ��ʴ��B��FeΪ������SnΪ������Fe����ʴ��C��ZnΪ������FeΪ������Fe����������A��B��C��������ʴ�����ʣ��ɿ쵽����˳����B��A��C����4��������ȼ�ϵ�ص��ܷ�Ӧ��������ȼ�շ�Ӧ������ѧ����ʽ��2H2+O2=2H2O������ع���һ��ʱ���������ˮ���ɣ��ܼ����ӣ�����������Һ��Ũ�ȼ�С��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ���Ӧ�������������

A. ͼ�ױ�ʾ���淴Ӧ���ʵ�Ũ����ʱ��ı仯������tʱ�̴ﵽƽ��
B. ͼ�ұ�ʾCH3COOH��Һ��ͨ��NH3�������Ĺ�������Һ�ĵ����Ա仯
C. ͼ����ʾij���ȷ�Ӧ�ֱ����С�����������£���Ӧ�����е������仯
D. ͼ����ʾ��ͬ�¶���ˮ��Һ��H+��OH-Ũ�ȵı仯���ߣ�ͼ���¶�T1<T2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����4 mol A�����2 mol B������2L �������л�Ϸ������·�Ӧ��2A��g��+B��g�� ![]() 2C��g������2s ����C��Ũ��Ϊ0.6molL-1�������м���˵����������ȷ������ ��
2C��g������2s ����C��Ũ��Ϊ0.6molL-1�������м���˵����������ȷ������ ��
A. ������A��ʾ�ķ�Ӧ��ƽ������Ϊ0.3 molL-1s-1
B. 2sʱ��ѹǿ����ʼʱ��1.1��
C. 2sʱ����A��ת����Ϊ30%
D. 2sʱ����B��Ũ��Ϊ0.7 molL-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��ԭ������������������ֶ�����Ԫ�أ�Aԭ�ӵĵ��Ӳ��������ĺ������������ͬ��A��C��B��D�ֱ�Ϊͬ���壬B��C������������֮����E��������������ͬ��A��E�γɵĻ����ﻯѧʽΪAE��������к�18�����ӣ���ش��������⣺
��1��EԪ�ص��ʵĻ�ѧʽΪ_____��DԪ�ص������ӵ��ṹʾ��ͼΪ______��
��2����A��B��C����Ԫ���γɵĻ�����ĵ���ʽΪ______�����ֻ������γɵľ����������Ļ�ѧ��������______��
��3��A��B��D����Ԫ���γɵ�һ�ֻ������A��B�γɵ�һ�ֻ������ܷ���������ԭ��Ӧ����Ӧ�Ļ�ѧ����ʽΪ________________________________
��4���ѵ���Eͨ��̼��������Һ�з�����Ӧ��д���ܷ�Ӧ�����ӷ���ʽ________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������пƬ�ʹ�ͭƬ��ͼʾ��ʽ����ͬŨ�ȵ�ϡ������һ��ʱ�䣬����������ȷ����

A�����ձ���ͭƬ����������ݲ���
B������ͭƬ������������ͭƬ�Ǹ���
C�����ձ�����Һ��pH����С
D���������ݵ��ٶȼױ��ҿ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧϰ���о���ѧ��һ����Ҫ���������з���������ǣ� ��
A��Na2O��Na2O2������������ B��H2SO4��CH3COOH��������
C���ռ������ڼ� D��Na2CO3��NaHCO3��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳ��ö���������Ư��ֽ����˿ë����ñ�ȣ�������������ܹ�����ù����ϸ������������������ʳ��ɹ��ķ��������������ϸ��չ����йط�Χ�ͱ�ʹ�ã��ҹ��涨���Ѿ���SO2�����ʹ����Ϊ0.25g/L��ij��ѧ��ȤС���Ʊ�����SO2�Ļ�ѧ���ʺ���;����̽����̽������ʵ��װ������ͼ���г�����ʡ�ԡ�
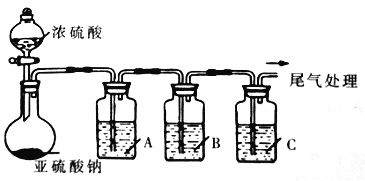
��1��ʵ���ѡ�õ�ʵ���Լ���Ũ���ᡢNa2SO3���塢Na2S��Һ��BaCl2��Һ��FeCl3��Һ��Ʒ����Һ�ȡ�
������������
�Լ� | ���� | |
A | _______ | ��֤SO2�Ļ�ԭ�� |
B | Na2S��Һ | ___ |
C | Ʒ����Һ | ___ |
��A�з�����Ӧ�����ӷ���ʽΪ_______________________��
��������װ����ͨ�������SO2��Ϊ����֤A�з�����������ԭ��Ӧ��ȡA����Һ�ֳ����ݣ������������ʵ�飺
����һ������һ����Һ�м��������ữ��KMnO4��Һ���Ϻ�ɫ��ȥ���÷����Ƿ����________������ǡ���
�����������ڶ�����Һ�м���K3[Fe(CN)6]��Һ��ʵ������Ϊ____________��
�ܸ�С�齫SO2ͨ���ữ�ĸ��������Һ�У�������Һ�еμ��Ȼ�����Һ�������а�ɫ�������ɣ�˵��SO2���л�ԭ�ԡ��÷����IJ���֮������Ϊ_____________��
��2������ȤС�����á�ֱ�ӵ������������Ѿ��е�SO2���в�����ȡ50.00ml���Ѿ���Ʒ��250ml����ƿ�С�������������飬�ټ���1ml����ָʾҺ��10ml������Һ����Ũ��Ϊcmol/L�ĵ���ζ���ҺѸ�ٵζ�������ɫ������30s���伴Ϊ�յ㣬�������ĵ���ζ���Һ�����ΪVml����ˮ������Ʒ�����հ����飬����ͬ�ϣ��հ��������ĵ���ζ���Һ�����ΪVoml�������Ѿ���SO2��������ʽΪ___g/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ����H++OH���TH2O ��ʾ���ǣ� ��
A.NaOH ��Һ��CO2 �ķ�Ӧ
B.Ba��OH��2 ��Һ��ϡH2SO4 �ķ�Ӧ
C.NaHSO4��Һ��KOH ��Ӧ
D.ʯ�����ϡH2SO4 �ķ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������-��(III)���K3 [Fe(C2O4)3]��3H2O (Mr=491)Ϊ��ɫ���壬������ˮ���������Ҵ����л��ܼ���110���¿�ʧȥ�ᾧˮ��230��ʱ���ֽ⣬���Ʊ������ͻ�������������Ҫԭ�ϡ������������Ϊԭ���Ʊ����������(III)��ؾ��������������ʾ��

��ش��������⣺
(1)ʵ������Ҳ����Fe3+�δ���������������Ʊ��þ��壬�����ü�Һ����Fe3+������ͬŨ�ȵ�NaOH��Һ��ˮͨ����ͬ������������ѡ��______�ܻ�ÿ����ϴ��Fe(OH)3��
(2)���������в���ˮԡ���ȣ���������¶�Ϊ40�棬������_______��������Ӧ�Ļ�ѧ����ʽΪ_______��������ȫ���轫������Һ��У�Ŀ����__________________��
(3)���ڹ���X������˵���в���ȷ����________________��
A.�ɲ�����ȴ������Һ�м����Ҵ��ķ�����ʹ��������
B��Ϊ�˿��ٵõ��ϸ���Ĺ��壬���Բ��ó��˵ķ���
C��ϴ�Ӿ���ʱ������������ˮϴ�������Ҵ�ϴ
D�����ü��Ⱥ�ɵķ����õ��ϸ���ľ���
��4��Ϊ�˷�����Ʒ���ȣ��������²�����
ȷ��ȡ��Ʒ0.9350g�����Ƴ�250mL��Һ��ÿ����ȡ25.00mL������ƿ�У���������ϡH2SO4�ữ����C2O42-ת��ΪH2C2O4����0.0100mol/LKMnO4��Һ�ζ����յ㣬������_______��ƽ�вⶨ���Σ�����KMnO4������ֱ�Ϊ20.02mL��19.98mL��20.00mL�������ôֲ�Ʒ�Ĵ���Ϊ_________________��(��֪��5 H2C2O4+2 MnO4-+6H+=10CO2��+2Mn2++8H2O)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com