
【题目】7.4g有机物A完全燃烧生成8.96LCO2(标准状况下)和9g水,有机物B是A的同系物,1molB完全燃烧消耗氧气的物质的量比1molA完全燃烧消耗氧气的物质的量多1.5mol,B能与Na反应生成H2。
(1)B的分子式为___。
(2)若A不能发生催化氧化反应,则A的结构简式为___,若B不能发生消去反应,则B的结构简式为___。
(3)若A、B的另外一种同系物C既不能发生催化氧化反应,也不能发生消去反应,则C至少有__个碳原子。
【答案】C5H12O CH3C(OH)(CH3)2 HOCH2C(CH3)3 13
【解析】
(1)根据质量守恒计算与A完全燃烧参加反应氧气的质量,根据n=![]() 计算氧气、水的量物质的量,根据n=
计算氧气、水的量物质的量,根据n=![]() 计算二氧化碳的物质的量,根据原子守恒计算A分子中C、H原子数目,判断A分子中是否含有氧原子并计算氧原子数目,确定A的最简式,据此确定A的分子式;B与A互为同系物,1mol B完全燃烧消耗氧气的物质的量比1molA完全燃烧消耗氧气的物质的量多1.5mol,则B比A多1个CH2原子团,确定B的分子式;
计算二氧化碳的物质的量,根据原子守恒计算A分子中C、H原子数目,判断A分子中是否含有氧原子并计算氧原子数目,确定A的最简式,据此确定A的分子式;B与A互为同系物,1mol B完全燃烧消耗氧气的物质的量比1molA完全燃烧消耗氧气的物质的量多1.5mol,则B比A多1个CH2原子团,确定B的分子式;
(2)A不能发生催化氧化,若含有-OH,则羟基连接的碳原子上没有H原子,B能与钠反应生成氢气,B分子中至少含有-OH、-COOH中的一种,B不能发生消去反应,若含有羟基,则与羟基相连的碳原子相邻的碳原子上没有氢原子,结合分子式确定A、B结构;
(3)C既不能发生催化氧化反应,也不能发生消去反应,若含有羟基,羟基连接的碳原子上没有H原子,与羟基相连的碳原子相邻的碳原子上没有氢原子,则羟基相连的碳原子,至少还连接3个-C(CH3)3,结合有机物A、B的分子式确定C中碳原子个数。
(1)8.96L CO2(标准状况下)的物质的量为![]() =0.4mol,故n(C)=0.4mol,二氧化碳的质量为0.4mol×44g/mol=17.6g,A完全燃烧参加反应氧气的质量为17.6g+9g-7.4g=19.2g,氧气的物质的量为
=0.4mol,故n(C)=0.4mol,二氧化碳的质量为0.4mol×44g/mol=17.6g,A完全燃烧参加反应氧气的质量为17.6g+9g-7.4g=19.2g,氧气的物质的量为![]() =0.6mol,水的物质的量为
=0.6mol,水的物质的量为![]() =0.5mol,n(H)=1mol,根据氧原子守恒可知,7.4g有机物中n(O)=0.4mol×2+0.5mol-0.6mol×2=0.1mol,故n(C):n(H):n(O)=0.4mol:1mol:0.1mol=4:10:1,根据C、H原子关系可知,4个C原子中最多需要10个H原子,故A的分子式为C4H10O,B与A互为同系物,1mol B完全燃烧消耗氧气的物质的量比1molA完全燃烧消耗氧气的物质的量多1.5mol,则B比A多1个CH2原子团,B的分子式C5H12O。
=0.5mol,n(H)=1mol,根据氧原子守恒可知,7.4g有机物中n(O)=0.4mol×2+0.5mol-0.6mol×2=0.1mol,故n(C):n(H):n(O)=0.4mol:1mol:0.1mol=4:10:1,根据C、H原子关系可知,4个C原子中最多需要10个H原子,故A的分子式为C4H10O,B与A互为同系物,1mol B完全燃烧消耗氧气的物质的量比1molA完全燃烧消耗氧气的物质的量多1.5mol,则B比A多1个CH2原子团,B的分子式C5H12O。
答案为C5H12O。
(2)B能与钠反应生成氢气,B分子中含有-OH,有机物B是A的同系物,则A中含有羟基,A不能发生催化氧化,则羟基连接的碳原子上没有H原子,故A的结构简式为CH3C(OH)(CH3)2,B不能发生消去反应,则与羟基相连的碳原子相邻的碳原子上没有氢原子,则B为HOCH2C(CH3)3;
答案为CH3C(OH)(CH3)2;HOCH2C(CH3)3。
(3)若A、B的另外一种同系物C既不能发生催化氧化反应,也不能发生消去反应,羟基连接的碳原子上没有H原子,与羟基相连的碳原子相邻的碳原子上没有氢原子,则羟基相连的碳原子至少还连接3个-C(CH3)3,该同系物至少含有碳原子数目为4×3+1=13;
答案为13。


科目:高中化学 来源: 题型:
【题目】M是聚合物胶黏剂、涂料等的单体,其一条合成路线如下(部分试剂及反应条件省略):
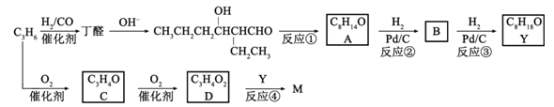
完成下列填空:
(1)反应①的反应类型是____________。反应④的反应条件是_____________。
(2)除催化氧化法外,由A得到![]() 所需试剂为___________。
所需试剂为___________。
(3)已知B能发生银镜反应。由反应②、反应③说明:在该条件下,_______________。
(4)写出结构简式。C________________ M________________
(5)D与1-丁醇反应的产物与氯乙烯共聚可提高聚合物性能,写出该共聚物的结构简式。_____________
(6)写出一种满足下列条件的丁醛的同分异构体的结构简式。____________
①不含羰基②含有3种不同化学环境的氢原子
已知:双键碳上连有羟基的结构不稳定。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果不正确的是( )
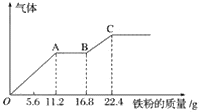
A.图中,AB段的反应为Fe+2Fe3+=3Fe2+,溶液中溶质最终为硫酸亚铁
B.原溶液中硫酸浓度为2.5 mol·L-1
C.原混合溶液中硝酸根离子的物质的量为0.2 mol
D.图中,OA段产生的气体是一氧化氮,BC段产生的气体是氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组所做的石蜡油(17个碳原子以上的烷烃)分解实验如图所示。下列有关说法正确的是
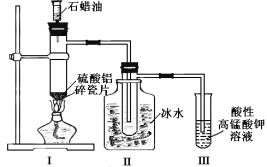
A.装置II中逸出的气体通入高锰酸钾溶液,发生加成反应
B.石蜡油分解生成的气体中只有烯烃
C.十八烷完全分解为乙烷和最多乙烯时,二者物质的量之比为1:8
D.装置I中硫酸铝和碎瓷片都是催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组利用如图装置进行乙醇的催化氧化实验制取乙醛,图中铁架台等装置已略去,粗黑线表示乳胶管。请填写下列空白:
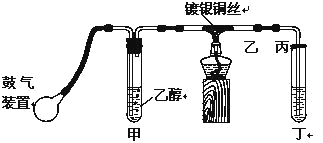
(1)甲装置常常浸在7080℃的水浴中,目的是__。
(2)实验时,先加热玻璃管乙中的镀银铜丝,约1分钟后鼓入空气,此时铜丝即呈红热状态。若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束。乙醇的催化氧化反应是__反应(填“放热”或“吸热”),该反应的化学方程式为__。
(3)该小组将丁中收集到的产物继续做实验探究:
①在试管中加入2毫升10%的___(填化学式)溶液,在滴加四到五滴2%的___(填化学式)溶液,配制成氢氧化铜悬浊液。然后加入丁中的产物,在酒精灯上加热,可以看到__。
②写出丁种物质与新制氢氧化铜反应的化学方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯酸可与水反应生成乳酸,化学方程式如下,下列说法正确的是

A. 该反应为加成反应,没有副产物生成
B. 可用Br2/CCl4溶液鉴别丙烯酸和乳酸
C. 丙烯酸与乳酸都属于有机酸,两者不发生反应
D. 1mol乳酸分别与足量Na、NaOH、NaHCO3反应,消耗三者物质的量之比为2:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL![]() 盐酸跟50mL
盐酸跟50mL![]() NaOH溶液中和反应过程中所放出的热量计算中和热。
NaOH溶液中和反应过程中所放出的热量计算中和热。
(1)烧杯间填满泡沫塑料的作用是______;
(2)大烧杯上若不盖硬纸板,求得的中和热数值______![]() 填“偏大”、“偏小”、“无影响”
填“偏大”、“偏小”、“无影响”![]()
(3)如图所示,仪器A的名称是______;

(4)重复三次实验,记录的实验数据如下:
实验用品 | 溶液温度 | |||
|
| |||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
已知:![]() ,反应后溶液的比热容c为
,反应后溶液的比热容c为![]() ,各物质的密度均为
,各物质的密度均为![]() 。计算
。计算![]() ______
______![]()
(5)实验中改用80mL![]() 盐酸跟100mL
盐酸跟100mL![]() NaOH溶液进行反应,与上述实验相比,所放出的热量______
NaOH溶液进行反应,与上述实验相比,所放出的热量______![]() 填“相等、“不相等”
填“相等、“不相等”![]() ,所求中和热______
,所求中和热______![]() 填“相等、“不相等”
填“相等、“不相等”![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸苄酯是一种有馥郁茉莉花香气的无色液体,沸点213 ℃,密度为1.055 g·cm-3,实验室制备少量乙酸苄酯的反应如下:CH2OH+(CH3CO)2O![]() CH2OOCCH3(乙酸苄酯)+CH3COOH
CH2OOCCH3(乙酸苄酯)+CH3COOH
实验步骤如下:
步骤1:三颈烧瓶中加入30 g (0.28 mol)苯甲醇、30 g乙酸酐(0.29 mol)和1 g无水CH3COONa,搅拌升温至110 ℃,回流4~6 h(装置如图所示):
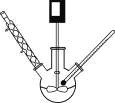
步骤2:反应物降温后,在搅拌下慢慢加入15%的Na2CO3溶液,直至无气泡放出为止。
步骤3:将有机相用15%的食盐水洗涤至中性。分出有机相,向有机相中加入少量无水CaCl2处理得粗产品。
步骤4:在粗产品中加入少量硼酸,减压蒸馏(1.87 kPa),收集98~100 ℃的馏分,即得产品。
(1) 步骤1中,加入无水CH3COONa的作用是_______________,合适的加热方式是_______。
(2) 步骤2中,Na2CO3溶液需慢慢加入,其原因是____________。
(3) 步骤3中,用15%的食盐水代替蒸馏水,除可减小乙酸苄酯的溶解度外,还因为_______________;加入无水CaCl2的作用是___________________。
(4) 步骤4中,采用减压蒸馏的目的是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某药物中间体的合成路线如下![]() 下列说法正确的是()
下列说法正确的是()
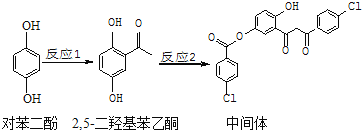
A.对苯二酚在空气中能稳定存在
B.1mol该中间体最多可与11![]() 反应
反应
C.2,![]() 二羟基苯乙酮能发生加成、取代、缩聚反应
二羟基苯乙酮能发生加成、取代、缩聚反应
D.该中间体分子中含有1个手性碳原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com