
| A. | ①最多 | B. | ③最多 | C. | 一样多 | D. | 无法判断 |
分析 n(Na)=$\frac{9.2g}{23g/mol}$=0.4mol,可与水发生:2Na+2H2O=2NaOH+H2↑,或与酸发生2Na+2HCl=2NaCl+H2↑,结合方程式解答该题.
解答 解:n(Na)=$\frac{9.2g}{23g/mol}$=0.4mol,可与水发生:2Na+2H2O=2NaOH+H2↑,或与酸发生2Na+2HCl=2NaCl+H2↑,
①②溶液中m(H2O)≥90g,n(H2O)≥5mol,
③中$\frac{100g×36.5%}{36.5g/mol}$=1mol,酸足量,
Na均完全反应,则生成氢气的质量相等.
故选C.
点评 本题考查化学方程式的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,难度中等,注意水的量为解答该题的关键.


 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:解答题
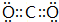 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
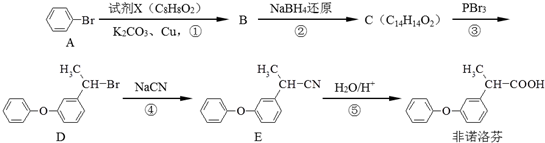
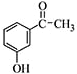 ;C:
;C: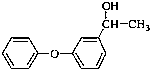 .
.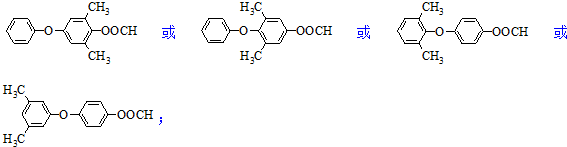 .
.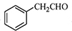 为原料制备
为原料制备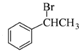 的合成路线流程图如下:
的合成路线流程图如下:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 800℃时,某密闭容器中存在如下反应:2NO2(g)?2NO(g)+O2(g)△H>0,若开始向容器中加入1mol/L的NO2,反应过程中NO的产率随时间的变化如图曲线I所示.
800℃时,某密闭容器中存在如下反应:2NO2(g)?2NO(g)+O2(g)△H>0,若开始向容器中加入1mol/L的NO2,反应过程中NO的产率随时间的变化如图曲线I所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- | |
| B. | 与Al能产生氢气的溶液:K+、SO42-、HCO3-、NH4+ | |
| C. | 碳酸氢钠溶液:K+、Na+、Cl-、SO42- | |
| D. | 常温下pH<7的溶液:K+、SiO32-、Na+、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
| A. | 平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L | |
| B. | 反应开始时,丙中的反应速率最快,甲中的反应速率最慢 | |
| C. | 平衡时,乙中CO2的转化率大于60% | |
| D. | 平衡时,甲中和丙中H2的转化率均是60% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com