
已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有10个电子,下列关系正确的是( )
A.质子数:c>b
B.金属性:X>W
C.氢化物的稳定性:H2Y>HZ
D.原子半径:X<W
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.乙醇分子可以看作是乙烷分子中的一个氢原子被—OH取代而形成的
B.乙醇分子中的氢原子都可以被钠置换
C.—OH和OH-两种微粒中质子数、电子数都相等
D.水和乙醇分子中的羟基化学性质完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数 (Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
(1)物质的量浓度均为0.1mol/L的下列四种溶液: ① Na2CO3溶液 ② NaHCO3溶液
③ NaF溶液 ④ NaClO溶液。依据数据判断pH由大到小的顺序是 。
(2)将浓度为0.1 mol/L HF溶液加水稀释一倍(假设温度不变),下列各量增大的是____。
A.c(H+) B.c(H+)·c(OH-) C.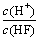 D.
D.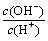
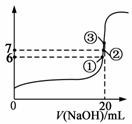 (3)25℃时,在20mL 0.1mol/L的氢氟酸溶液中加入VmL 0.1mol/L NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是 。
(3)25℃时,在20mL 0.1mol/L的氢氟酸溶液中加入VmL 0.1mol/L NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是 。
A.pH=3的HF溶液和pH=11的NaF溶液中,
由水电离出的c(H+)相等
B.在①点时pH=6,此时溶液中,
c(F-)-c(Na+) = 9.9×10-7mol/L
C.在②点时,溶液中的c(F-) = c(Na+)
D.在③点时V=20mL,此时溶液中c(F—) < c(Na+)=0.1mol/L
(4)在25℃时,Ksp[Cu(OH)2] =2.0×10-20。 某CuCl2溶液里C(Cu2+)= 0.02 mol·L-1,
如果要生成Cu(OH) 2沉淀,应调整溶液的pH使之大于 。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B两种非金属元素:①A比B容易与H2化合;②A原子能与B阴离子发生置换反应;③A的最高价氧化物水化物的酸性比B的最高价氧化物水化物的酸性强;④与某金属反应时,A原子得电子数目比B多;⑤A单质熔、沸点比B单质低。能说明A比B非金属性强的是( )
A.只有①② B.只有④
C.只有①②③ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学做元素周期律性质递变规律实验时设计了一套实验方案,并记录了有关实验现象,见下表。请从下表实验现象(Ⅱ)中选出与方案(Ⅰ)对应的实验现象,将其序号(A、B…)填入(Ⅲ)中,并写出相应的化学方程式。
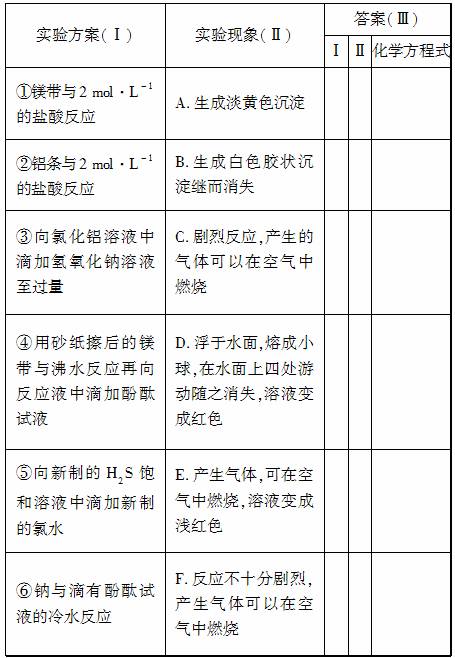
(1)该同学的实验目的是________________________________。
(2)从实验结果可以得出的结论是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热ΔH为-57.3 kJ/mol,辛烷的标准燃烧热为-5 518 kJ/mol。下列热化学方程式书写正确的是( )
A.2H+(aq)+SO (aq)+Ba2+(aq)+2OH-(aq)===BaSO4(s)+2H2O(l) ΔH=-57.3 kJ/mol
(aq)+Ba2+(aq)+2OH-(aq)===BaSO4(s)+2H2O(l) ΔH=-57.3 kJ/mol
B.KOH(aq)+ H2SO4(aq)===
H2SO4(aq)=== K2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol
K2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol
C.C8H18(l)+ O2(g)===8CO2(g)+9H2O(g) ΔH=-5 518 kJ/mol
O2(g)===8CO2(g)+9H2O(g) ΔH=-5 518 kJ/mol
D.2C8H18(g)+25O2(g)===16CO2(g)+18H2O(l) ΔH=-5 518 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质全部是弱电解质的是( )
A.H2O、NH3·H2O、H3PO4、HF
B.Cu(OH)2、CH3COOH、C2H5OH、CH3COONa
C.H2SO3、Ba(OH)2、BaSO4
D.H2SiO3、H2S、CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物的结构简式为CH2===CH—COOH。
请回答:
(1)写出该有机物官能团的名称及检验官能团的试剂。
(2)写出该有机物在一定条件下发生加聚反应的化学方程式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com