
在含0.3mol AlCl3的氯化铝溶液中加入200 mL烧碱溶液,能生成0.1mol沉淀,则加入烧碱溶液物质的量浓度可能是:①1.5 mol·L-1 ②4.5 mol·L-1 ③5.5 mol·L-1 ( )
A.② B.① C.③ D.①、③
D
【解析】
试题分析:通过发生的化学反应进行计算
假设烧碱少量,发生的化学反应只有Al3++3OH-═Al(OH)3↓,生成0.1mol沉淀,烧碱的物质的量为0.3mol,浓度为1.5 mol·L-1。
假设烧碱过量,发生的化学反应有Al3++3OH-═Al(OH)3↓和Al(OH)3+OH-═AlO2-+2H2O,生成0.1mol沉淀,烧碱的物质的量为0.3mol为1.1mol,浓度为5.5 mol·L-1。
故选D。
考点:化学方程式的有关计算
点评:本题考查铝离子与碱的反应,明确碱的物质的量对发生的化学反应的影响,根据氢氧化钠与氢氧化铝中氢氧根的物质的量判断,氯化铝在两溶液中反应情况是解答的关键,难度中等。


科目:高中化学 来源: 题型:
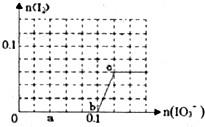 已知:还原性HSO3->I-,氧化性IO3->I2.在含0.3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )
已知:还原性HSO3->I-,氧化性IO3->I2.在含0.3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )| A、0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-═3SO42-+I-+3H+ | B、a点时消耗NaHSO3的物质的量为0.12mol | C、当溶液中I-与I2的物质的量之比为5:2时,加入的KIO3为0.18mol | D、b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省师大附中高一下学期期中考试化学试卷(带解析) 题型:单选题
在含0.3mol AlCl3的氯化铝溶液中加入200 mL烧碱溶液,能生成0.1mol沉淀,则加入烧碱溶液物质的量浓度可能是:①1.5 mol·L-1 ②4.5 mol·L-1 ③5.5 mol·L-1 ( )
| A.② | B.① | C.③ | D.①、③ |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年陕西省渭南市高三第二次模拟理综化学试卷(解析版) 题型:选择题
已知:还原性HSO—3>I—,氧化性IO—3>I2。在含0.3mol NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如右图所示。下列说法不正确的是

A.0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+
B.a点时消耗NaHSO3的物质的量为0.12mol
C.当溶液中I—与I2的物质的量之比为5:2时,加入的KIO3为0.18mol
D.b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2
查看答案和解析>>
科目:高中化学 来源: 题型:单选题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com