
 Mg(OH)2+2HCl↑,Mg(OH)2
Mg(OH)2+2HCl↑,Mg(OH)2 MgO+H2O或MgCl2+H2O
MgO+H2O或MgCl2+H2O MgO+2HCl↑,
MgO+2HCl↑, Mg(OH)2+2HCl↑,Mg(OH)2
Mg(OH)2+2HCl↑,Mg(OH)2 MgO+H2O或MgCl2+H2O
MgO+H2O或MgCl2+H2O MgO+2HCl↑.
MgO+2HCl↑.

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| O | 2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
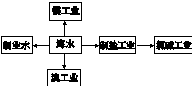
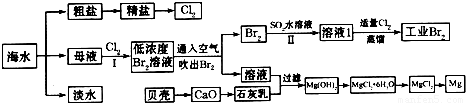
| A、海水制淡水主要有蒸馏法、电渗析法、离子交换法等 | B、海水制盐、发展氯碱工业都是发生物理变化 | C、海水提溴过程中先通入Cl2将溴离子氧化为溴单质 | D、工业上用电解熔融MgCl2的方法制取金属镁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com