
 (3)右图是一个电化学装置示意图。用肼——空气燃料电池做此装置的电源。
(3)右图是一个电化学装置示意图。用肼——空气燃料电池做此装置的电源。
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 如下图所示。下列有关叙述正确的是
如下图所示。下列有关叙述正确的是
| A.在外电路中,电子由银电极流向铜电极 |
| B.取出盐桥后,电流计的指针仍发生偏转 |
| C.外电路中每通过0.1mol电子,铜的质量理论上减小6.4g |
| D.原电池的总反应式为Cu+2AgNO3==2Ag+Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 酸的物质的量浓度是 mol·L-1
酸的物质的量浓度是 mol·L-1 的质量。
的质量。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 AsO33—+I2+H2O是可逆反应。设计如图装置(盐桥中的阴、阳离子可以自由移动,盐桥在原电池中不参与反应,只起导体作用),分别进行下述操作:(Ⅰ)向(B)烧杯中逐滴加入浓盐酸,(Ⅱ)向(B)烧杯中逐滴加入40%NaOH溶液。结果均发现电流计指针偏转。据此,下列判断正确的是
AsO33—+I2+H2O是可逆反应。设计如图装置(盐桥中的阴、阳离子可以自由移动,盐桥在原电池中不参与反应,只起导体作用),分别进行下述操作:(Ⅰ)向(B)烧杯中逐滴加入浓盐酸,(Ⅱ)向(B)烧杯中逐滴加入40%NaOH溶液。结果均发现电流计指针偏转。据此,下列判断正确的是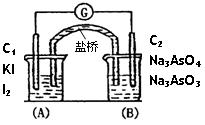
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com