
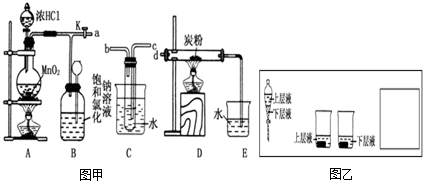
| ||
| ||


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 绿矾(FeSO4?7H2O)是重要的化学化工试剂,工业上常利用机械加工行业产生的废铁屑为原料制备.
绿矾(FeSO4?7H2O)是重要的化学化工试剂,工业上常利用机械加工行业产生的废铁屑为原料制备.| 序号 | 反应物用量 | 产品质量 |
| 1 | n(H2SO4):n(Fe)>1:1 | 介于Ⅰ级~Ⅱ级之间 |
| 2 | n(H2SO4):n(Fe)<1:1 | 优于Ⅰ级 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
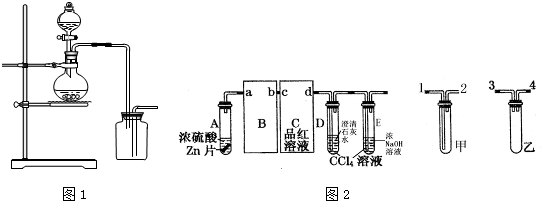
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省泰安市高三(上)期中化学试卷(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com