
| A. | 按F、Cl、Br、I的顺序,卤素单质的熔沸点相应升高 | |
| B. | 烷烃随碳原子数目增加,熔沸点相应升高 | |
| C. | 冰的密度低于液态水的密度,冰会浮在水面上 | |
| D. | 按O、S、Se、Te的顺序,氧族元素的气态氢化物稳定性逐渐减弱 |
分析 A、卤素单质原子序数递增分子间作用力增大,其熔点、沸点也随着原子序数递增而升高;
B、烷烃随碳原子数目增加,相对分子量增大,分子间作用力变大,熔沸点相应升高;
C、水分子间存在氢键,氢键具有方向性和饱和性,导致体积膨胀,所以冰的密度低于液态水的密度,冰会浮在水面上;
D、与元素非金属性强弱有关.
解答 解:A、卤素单质原子序数递增分子间作用力增大,其熔点、沸点也随着原子序数递增而升高,所以与分子间作用力有关,故A不选;
B、烷烃随碳原子数目增加,相对分子量增大,分子间作用力变大,熔沸点相应升高,所以与分子间作用力有关,故B不选;
C、水分子间存在氢键,氢键具有方向性和饱和性,导致体积膨胀,所以冰的密度低于液态水的密度,冰会浮在水面上,所以与氢键有关,故C不选;
D、O、S、Se、Te非金属性减弱,氧族元素的气态氢化物稳定性逐渐减弱,而分子间作用力或氢键无关,故D选;
故选D.
点评 本题考查了分子晶体的熔沸和密度的大小,主要考查了晶体中微粒间的作用力对晶体性质的影响,题目难度不大.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的稳定性为H2T<H2R | |
| B. | 单质与稀盐酸反应的剧烈程度为L<Q | |
| C. | R最高价氧化物对应水化物是强酸 | |
| D. | L2+与R2-的核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学视角是现代人所必须具备的科学素养中的重要组成部分 | |
| B. | 元素周期律的发现过程体现了物质分类思想和方法的运用 | |
| C. | 能源是现代文明的原动力,能源的开发和利用离不开化学 | |
| D. | 自然界一切物质都是由离子构成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Fe3+、Cl-、OH- | B. | Ba2+、HCO3-、Cl-、Na+ | ||
| C. | Fe2+、SO42-、H+、NO3- | D. | K+、NH4+、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提高燃料的燃烧效率的意义在于节约能源、节省资源、减少污染 | |
| B. | CO、NO、NO2、SO2都是大气污染气体,在空气中都能稳定存在 | |
| C. | 按照绿色化学的原则,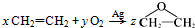 (式中的系数x,y,z均为整数),则(x+y+z)的最小数值为5 (式中的系数x,y,z均为整数),则(x+y+z)的最小数值为5 | |
| D. | 使用“无磷洗涤剂”,防止水体富营养化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
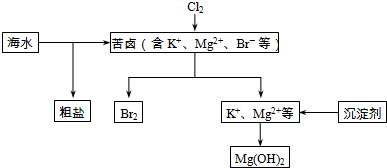
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铁作电极电解饱和食盐水:Fe+2H2O$\frac{\underline{\;电解\;}}{\;}$Fe(OH)2+H2↑ | |
| B. | 偏铝酸钠溶液能使酚酞试液变红:AlO2-+2H2O?Al(OH)3+OH- | |
| C. | 苯酚钠溶液中通入 | |
| D. | AgOH沉淀溶于氨水:AgOH+2NH3•H2O═[Ag(NH3)2]++OH-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3和O2反应 | B. | NH3和HNO3反应 | C. | NO和O2反应 | D. | NH3和水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯可发生加成反应 | |
| B. | 石油干馏可得到汽油、煤油等 | |
| C. | 在水溶液里,乙酸分子中的-CH3可以电离出H+ | |
| D. | 在浓硫酸存在下,苯与浓硝酸共热生成硝基苯的反应属于取代反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com