
下列叙述正确的是
A.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极区产生的Cl2进入阳极区
B.电解精炼铜时,反应开始一段时间内阳极溶解铜的质量比阴极析出铜的质量大
C.海轮外壳上镶入锌块,可减缓船体的腐蚀
D.在铁片上镀铜时,若铁片增重3.2g,则电路中通过的电子的物质的量为0.05mol
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源:2014高考名师推荐化学--预测13 题型:选择题
下列结论不正确的是
A粒子半径:S>S2->Cl-
B氢化物沸点:H2O>HF>HCl
C结合质子能力:OH->SiO>CO
D离子还原性:S2->I->Br-
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测11 题型:选择题
下列化学用语表示正确的是
A.表示氢气燃烧热的热化学方程式:2H2(g)+O2(g)= 2H2O(1)△H= -571.6kJ/mol
B.肥皂(主要成分为RCOONa)的水溶液显碱性:RCOO-+H2O RCOOH+OH-
RCOOH+OH-
C.实验室制氯气的离子方程式:MnO2+4H++4Cl- MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
D.乙酸与乙醇反应的化学方程式:CH3CO18OH+C2H5OH CH3CO18OC2H5+H2O
CH3CO18OC2H5+H2O
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测10 题型:推断题
【有机物化学基础】

有机物G是制备液晶材料的中间体之一,其结构简式为:

G的一种合成路线如下:其中,A~F分别代表一种有机化合物,合成路线中的部分产物及反应条件已略去。
已知:X的核磁共振氢谱只有1种峰;RCH=CH2 RCH2CH2OH;通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。请回答下列问题:
RCH2CH2OH;通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。请回答下列问题:
(1)A的结构简式是 ;C中官能团的名称是 。
(2)B的名称是 。第①~⑦步中属于取代反应的有 (填步骤编号)
(3)写出反应⑤的化学方程式 。
(4)第⑦步反应的化学方程式是 。
(5)G经催化氧化得到Y(C11H12O4),写出同时满足下列条件的Y的所有同分异构体的结构简式 。
a.苯环上的一氯代物有2种; b.水解生成二元羧酸和醇。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测10 题型:选择题
右图所示装置中,a、b、c、d、e、f均为惰性电极,电解质溶液均足量。接通电源后,d极附近显红色。下列说法正确的是

A.电源B端是正极
B.a、c电极均有单质生成,其物质的量之比为2:1
C.欲用丁装置给铜镀银,N应为Ag,电解液为AgNO3溶液
D.f极附近变红,说明氢氧化铁胶粒带正电荷
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测1 题型:简答题
联氨(N2H4)及其衍生物是一类重要的火箭燃料。N2H4与N2O4反应能放出大量的热。
 (1)已知:2NO2(g)
(1)已知:2NO2(g) N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中此反应达到平衡。
N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中此反应达到平衡。 其他条件不变时,下列措施不能使NO2转化率提高的是
其他条件不变时,下列措施不能使NO2转化率提高的是

 A.减少NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
A.减少NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
 (2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量。则反应2N2H4(l)+N2
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量。则反应2N2H4(l)+N2 O4(l)=3N2(g)+4H2O(l)的△H= kJ·mol-1。
O4(l)=3N2(g)+4H2O(l)的△H= kJ·mol-1。
 (3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300 mol·L-1、c(N2O4)=0.0120 mol·L-1。计算反应2NO2(g)
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300 mol·L-1、c(N2O4)=0.0120 mol·L-1。计算反应2NO2(g) N2O4(g)的平衡常数K= 。
N2O4(g)的平衡常数K= 。
 (4)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因 。
(4)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因 。
(5)已知在相同条件下N2H4?H2O的电离程度大于N2H5C1的水解程度。常温下,若将0.2mol/L N2H4?H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H5+、Cl-、OH-、H+离子浓度由大到小的顺序为:__________。
(6)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.肼-空气燃料电池放电时,负极的电极反应式是 ,电池工作一段时间后,电解质溶液的pH将 (填“增大”、“减小”、“不变”)。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测1 题型:选择题
金属锌为活泼金属,易被腐蚀。下列关于锌的腐蚀说法正确的是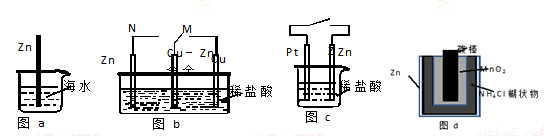
A.图a中,??入海水中的锌棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn-MnO2干电池自放电腐蚀主要是由Zn的氧化作用引起的
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测 题型:选择题
25 ℃时,0.1 mol/L的HA溶液中c(H+)/c(OH-)=l×l06,下列叙述正确的是
A.该溶液中由水电离出的c(H+)=l×10-13 mol/L
B.由pH=4的HA与pH=10的NaOH溶液等体积混合,溶液中c(Na+)>c(A-)>c(OH一)>c(H+)
C. 浓度均为0.1 mol/L的HA和NaA溶液等体积混合,若溶液呈酸性,则c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-)
D.0.1 mol·L-1 HA溶液与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中c(H+)+c(Na+)=c(OH-)+c(A-)
查看答案和解析>>
科目:高中化学 来源:2014福建安溪一中、养正中学、惠安一中高一下学期期末化学试卷(解析版) 题型:选择题
决定元素种类的因素是( )
A.核外电子数 B.最外层电子数 C.核电荷数 D.中子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com