
分析 (1)由n=cV可知,同物质的量浓度、同体积的氯化钾、氯化钙、硫酸钾、氯化铝、硫酸铝溶液中,溶质的物质的量相同,结合物质构成分析;
(2)结合n=$\frac{N}{{N}_{A}}$、c=$\frac{n}{V}$及SO42-+Ba2+=BaSO4↓计算.
解答 解:(1)由n=cV可知,同物质的量浓度、同体积的氯化钾、氯化钙、硫酸钾、氯化铝、硫酸铝溶液中,溶质的物质的量相同,设均为1mol,分别含离子为2mol、3mol、3mol、4mol、5mol,则所含溶质阴阳离子总数最多的是Al2(SO4)3,故答案为:Al2(SO4)3;
(2)n(SO42-)=$\frac{N}{{N}_{A}}$=$\frac{1.505×1{0}^{23}}{6.02×1{0}^{23}}$=0.25mol,c(SO42-)=$\frac{n}{V}$=$\frac{0.25mol}{0.5L}$=0.5mol/L,由SO42-+Ba2+=BaSO4↓可知,需要加入1 mol•L-1 的氯化钡溶液的体积是$\frac{0.05L×0.5mol/L}{1mol/L}$=0.025L=25mL,故答案为:0.5;25mL.
点评 本题考查物质的量浓度的计算,为高频考点,把握物质的量为中心的基本计算公式为解答的关键,侧重分析与计算能力的考查,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | AlCl3,H2SO4,KOH | B. | BaCl2,NaOH,KHCO3 | ||
| C. | AgNO3,HNO3,NaBr | D. | FeCl3,HNO3,Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

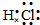 ,甲的组成元素的原子结构示意图
,甲的组成元素的原子结构示意图 ,能证明甲的组成元素非金属性很强的事实氟气和氢气在黑暗处能产生爆炸.(任举一例即可)
,能证明甲的组成元素非金属性很强的事实氟气和氢气在黑暗处能产生爆炸.(任举一例即可)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0×10-4 mol/L | B. | 1.0×10-8 mol/L | ||
| C. | 1.0×10-11 mol/L | D. | 1.0×10-10 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22 | B. | 22mol | C. | 44g | D. | 44g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23g钠的原子最外层电子数为2NA | |
| B. | 1L0.1mol•L-1乙酸溶液中H+数为0.1NA | |
| C. | 标准状况下,22.4L乙烷的分子数为NA | |
| D. | 1mol甲基所含质子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向蔗糖溶液中加入稀硫酸,加热,冷却后加入新制Cu(OH)2检验水解产物 | |
| B. | 用酸性高锰酸钾溶液鉴别乙烷与乙烯 | |
| C. | 用饱和Na2CO3溶液除去乙酸乙酯中的少量乙酸 | |
| D. | 利用燃烧的方法鉴别羊毛和蚕丝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com