
| ||
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2014届湖北省高三上学期期中联考化学试卷(解析版) 题型:填空题
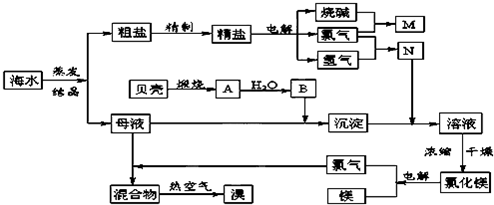
海水中含有极为丰富的自然资源。很多常见的金属元素和非金属元素主要以简单离子的形式存在于海水中,海水呈弱碱性。回答下列问题:
海水提溴过程一般分三步,①向浓缩的海水中通入Cl2,将其中的Br-氧化,2Br-+Cl2=Br2+2Cl-,再用热空气吹出溴;②然后用饱和碳酸钠溶液吸收溴,溴歧化为NaBr、NaBrO3,③最后用硫酸酸化5NaBr+NaBrO3+3H2SO4=3Na2SO4+3Br2+3H2O
(1)写出第②步反应的离子方程式 ;
(2)海水浓缩后还要进一步处理才能通入Cl2,处理的方法是 ,目的是 ,步骤③用硫酸而不用盐酸酸化的原因可能是 ;
(3)为了除去工业Br2中微量的Cl2,可向工业Br2中 ;
a.通入HBr b.加入Na2CO3溶液 c.加入NaBr溶液 d.加入Na2SO3溶液
(4)海水制溴的原理体现了化学工业中“富集”“放大”思想。以海水为原料制备金属镁分三步,试写出其反应原理(用化学方程式表示)
, , 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
卤族元素(9F、17Cl、35Br、53I、85At)是重要的非金属元素,它们的单质及其化合物不仅在无机化学中有极其广泛的应用,而且在有机化学中也表现不俗。请回答下列有关问题:
(1)指出氯元素在元素周期表中的位置 ;
(2)下列关于卤族元素的叙述不正确的是 (填字母);
A.卤素单质的颜色随原子序数的递增,由浅到深
B.卤化氢的沸点随原子序数的递增,由低到高
C.新制的氯水滴加到碘化钾溶液中,再滴加淀粉溶液呈蓝色,说明氯元素非金属性比碘强
D.氯化铁溶液中混有少量氯化亚铁,可滴加适量溴水除去
(3)利用你所学的有机反应,用化学方程式表示在有机化合物分子中引入卤素原子的方法
① 引入一个卤素原子,且属于取代反应: ;
② 引入两个卤素原子,且属于加成反应: ;
③ 引入四个卤素原子,且属于加成反应: 。
(4)海水中含有丰富的卤素,其中提取溴的一种工艺方法是在预先经过酸化的浓缩海水中通入氯气使溴离子转化成单质溴,继而通入空气和水蒸气,将溴吹入吸收塔,使溴蒸气和吸收剂SO2发生作用转化成氢溴酸以达到富集的目的。然后再用氯气将其氧化得到产品溴。
① 写出第二步转化的离子方程式: ;
② 用此法从海水中提取1mol溴单质,总共需要氯气 mol。
(5) 某校探究小组将少量粉末状硫磺撒到新制氯水中,充分振荡,硫磺粉消失,并检测到有两种强酸生成。写出该反应的化学方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com