
将4.34 g Na、Na2O、Na2O2的混合物与足量的水反应,在标准状况下得到672 mL混合气体,将混合气体通电后恰好完全反应,则Na、Na2O、Na2O2的物质的量之比为 ( )
A.4∶3∶2 B.1∶2∶1
C.1∶1∶2 D.1∶1∶1
科目:高中化学 来源: 题型:
室温下,将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2;CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s)  CuSO4(s)+5H2O(l), 热效应为△H3。则下列判断正确的是
CuSO4(s)+5H2O(l), 热效应为△H3。则下列判断正确的是
A.△H2>△H3  B.△H1<△H3
B.△H1<△H3
C.△H1+△H3 =△H2  D.△H1+△H2 >△H3
D.△H1+△H2 >△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C是由周期表中短周期元素组成的三种常见化合物,甲、乙、丙是三种单质,这些单质和化合物之间存在如图所示的关系:
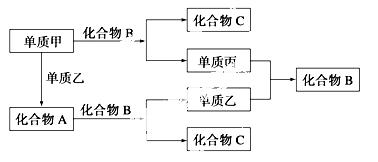
完成下列空白:
(1)A、B、C的化学式分别为________、______、______。
(2)单质甲与化合物B反应的离子方程 式为________________。
式为________________。
(3)在A、B、C三种化合物中,必定含有的元素是________(用元素符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。
完成下列计算:
(1)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生40.32 L(标准状况下)氮气,至少需要叠氮化钠________g。
(2)钠钾合金可在核反应堆中用作热交换液。5.05 g钠钾合金溶于200 mL水生成0.075 mol氢气。
①计算溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化)。
②计算并确定该钠钾合金的化学式。
(3)氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液。向该溶液中通入二氧化碳,有下列反应:
2NaAl(OH)4+CO2—→2Al(OH)3↓+Na2CO3+H2O
已知通入二氧化碳336 L(标准状况下),生成24 mol Al(OH)3和15 mol Na2CO3,若通入溶液的二氧化碳为1 12 L(标准状况下),计算生成的Al(OH)3和Na2CO3的物质的量之比。
12 L(标准状况下),计算生成的Al(OH)3和Na2CO3的物质的量之比。
(4)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失。
| 氢氧化钠质量(g) | 氯化钠质量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
上述实验①②③所用氢氧化钠均不含杂质,且实验数据可靠。通过计算,分析和比较上表3组数据,给出结论。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,向饱和烧碱溶液中放入少量过氧化钠,反应后恢复到原来的温度,下列说法中正确的是 ( )
A.溶液的pH增大,有O2放出
 B.溶液的pH不变,有O2放出
B.溶液的pH不变,有O2放出
C.溶液的c(Na+)增大,有O2放出
D.溶液的c(OH-)增大,有O2放出
查看答案和解析>>
科目:高中化学 来源: 题型:
在1.00L 1mol/L氢氧化钠溶液中通入16.8L标准状况下的CO2气体,所得的溶液中含有的溶质是( )
A.Na2CO3 B.NaHCO3
C.Na2CO3和NaHCO3 D.NaOH、Na2CO3和NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
把足量CO2通入含NaOH 0.8 g的烧碱溶液中,将产物在一定条件下蒸干后,得到Na2CO3和NaHCO3固体混合物1.37 g,则通入CO2的质量是( )
A.0.44 g B.0.88 g
C.0.66 g D.都不是
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列有FeCl3溶液参加的反应中,与Fe3+发生氧化还原反应的是( )
①FeCl3与Cu反应 ②FeCl3与H2S反应 ③FeCl3与KI反应 ④FeCl3滴入沸水中 ⑤FeCl3与NaHCO3反应 ⑥FeCl3溶液中滴入石蕊试液
A.③④⑤⑥ B.③④⑤ C.④⑤⑥ D.①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com