
分析 电解质,在水溶液里或熔融状态下能导电的化合物是电解质;
非电解质,在水溶液里或熔融状态下都不能导电的化合物,该定义的前提必须是化合物;
导电原因:只要含有自由移动的离子或自由电子即可;
能和碱反应生成盐和水的氧化物为酸性氧化物;
能和酸反应生成盐和水的氧化物为碱性氧化物.
书写电离方程式时应注意电解质的强弱,如果是弱电解质,则用可逆号,如果是强电解质,则用等号.据此分析.
解答 解:(1)盐酸有自由移动的离子,能导电,属于混合物,既不是电解质也不是非电解质;
(2)酒精没有自由移动的离子,不能导电,属于非电解质;
(3)SO2 没有自由移动的离子,不能导电,属于非电解质;由于能和碱反应生成盐和水,故为酸性氧化物;
(4)熔融的BaSO4 能导电,是盐,属于电解质;
(5)液态HCl没有自由移动的离子,不能导电,溶于水能导电,属于电解质;
(6)硫酸是共价化合物,故纯硫酸不导电,但硫酸溶于水后能电离出自由移动的离子,故属于电解质;
(7)硝酸是共价化合物,故纯硝酸不导电,但硝酸溶于水后能电离出自由移动的离子,故属于电解质;
(8)乙酸是共价化合物,故纯乙酸导电,但乙酸溶于水后能电离出自由移动的离子,故属于电解质;
(9)蔗糖是共价化合物,故蔗糖不导电,在溶于水后和熔融状态下均不导电,故属于非电解质;
(10)铜能导电,是金属单质,既不是电解质也不是非电解质;
(11)CaO是离子化合物,固态时不能导电,但熔化状态下能导电,属于电解质;由于能和酸反应生成盐和水,故为碱性氧化物;
(12)MgO属于离子化合物,固态氧化镁不能导电,但在熔融状态下能导电,故属于电解质;由于能和酸反应生成盐和水,故为碱性氧化物;
(13)Al2O3是离子化合物,固态时不能导电,但熔化状态下能导电,故属于电解质;由于既能和酸又能和碱反应生成盐和水,故为两性氧化物;
(14)Mn2O7是离子化合物,固态时不能导电,但熔化状态下能导电,故属于电解质;由于能和碱反应生成盐和水,故为酸性氧化物‘
(15)CO2是共价化合物,无自由移动离子,故不能导电;在水溶液中和熔融状态下均不导电,故为非电解质;由于能和碱反应生成盐和水,故为酸性氧化物.
依据分析:上述物质属于电解质的是:(4)(5)(6)(7)(8)(11)(12)(13)(14);
属于非电解质的是:(2)(3)(9)(15);
能导电的是:(1)(4)(10);
属于酸性氧化物的是:(3)(15);
属于碱性氧化物的是:(11)(12);
任选一个电解质写出相应的电离方程式:如液态HCl是电解质,在溶液中发生电离HCl=H++Cl-;HNO3是强电解质,在水溶液中电离方程式为:HNO3=H++NO3-.
故答案为:(4)(5)(6)(7)(8)(11)(12)(13)(14);(2)(3)(9)(15);(1)(4)(10);(3)(15);(11)(12);HCl=H++Cl-;
HNO3=H++NO3-..
点评 本题考查了电解质溶液导电的原因及电解质、非电解质、弱电解质的定义,能导电的不一定是电解质,如硝酸钾溶液;电解质不一定能导电,如硫酸铜晶体.


 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 盐酸中的c(Cl-)与醋酸溶液中的c(CH3COO-)相等 | |
| B. | 分别与足量CaCO3反应,放出的CO2一样多 | |
| C. | 分别用水稀释相同倍数,n(Cl-)<n(CH3COO-) | |
| D. | 分别将两溶液升温至80℃,醋酸溶液的pH变小,盐酸的pH不变(不考虑挥发) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向氯化铝溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O | |
| B. | 金属钠与水反应:Na+H2O=Na++OH-+H2↑ | |
| C. | Ba(OH)2溶液中滴加少量NH4HCO3溶液:NH4++HCO3-+2OH-+Ba2+=NH3•H2O+H2O+BaCO3↓ | |
| D. | 用铁棒作阴极、炭棒作阳极电解饱和氯化钠溶液:2C1-+2H2O $\frac{\underline{\;电解\;}}{\;}$ H2↑+Cl2↑+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | l00mL0.4 mol•L-1KNO3溶液 | B. | 100mL0.2mol•L-1Cu(NO3)2溶液 | ||
| C. | 200mLO.l mol•L-1Fe(NO3)2溶液 | D. | 400mLO.l mol•L-1Al(NO3)3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
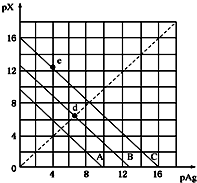 某温度时,卤化银(AgX,X=Cl,Br,I)的3条溶解平衡曲线如图所示,AgCl,AgBr,AgI的Ksp依次减小.已知pAg=-lgc(Ag+),pX=-lgc(X-),利用pX-pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是( )
某温度时,卤化银(AgX,X=Cl,Br,I)的3条溶解平衡曲线如图所示,AgCl,AgBr,AgI的Ksp依次减小.已知pAg=-lgc(Ag+),pX=-lgc(X-),利用pX-pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是( )| A. | A线是AgCl的溶解平衡曲线,C线是AgI的溶解 | |
| B. | 坐标点(8,4)形成的溶液是AgCl的不饱和溶液平衡曲线 | |
| C. | d点是在水中加入足量的AgBr形成的饱和溶液 | |
| D. | e点表示由过量的KI与AgNO3反应产生AgI沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 | |
| B. | 用聚乳酸塑料代替聚乙烯塑料能减少白色污染 | |
| C. | 金属汞一旦洒落在实验室地面或桌面时,必须尽可能收集,并深埋处理 | |
| D. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22 g 2H218O中含有的质子数为10NA | |
| B. | 标准状况下,2.24 L乙醇中含有的C-H键数目为0.5NA | |
| C. | 0.1 mol/L的NaF溶液中所含F-的数目小于0.1NA | |
| D. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去0.5NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com