£Ø2012?ÖŲĒģ£©½šøÕŹÆ”¢SiC¾ßÓŠÓÅĮ¼µÄÄĶÄ„”¢ÄĶøÆŹ“ĢŲŠŌ£¬Ó¦ÓĆ¹ć·ŗ£®
£Ø1£©Ģ¼Óė¶ĢÖÜĘŚŌŖĖŲQµÄµ„ÖŹ»ÆŗĻ½öÄÜÉś³ÉĮ½ÖÖ³£¼ūĘųĢ¬»ÆŗĻĪļ£¬ĘäÖŠŅ»ÖÖ»ÆŗĻĪļRĪŖ·Ē¼«ŠŌ·Ö×Ó£®Ģ¼ŌŖĖŲŌŚÖÜĘŚ±ķÖŠµÄĪ»ÖĆŹĒ
µŚ¶žÖÜĘŚµŚ¢ōA×å
µŚ¶žÖÜĘŚµŚ¢ōA×å
£¬QŹĒ
Ńõ£Ø»ņO£©
Ńõ£Ø»ņO£©
£¬RµÄµē×ÓŹ½ĪŖ
£®
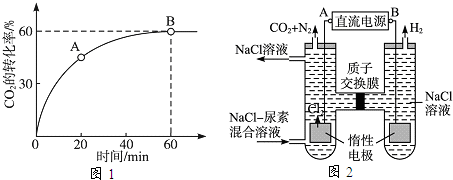
£Ø2£©Ņ»¶ØĢõ¼žĻĀ£¬Na»¹ŌCCl
4æÉÖʱø½šøÕŹÆ£¬·“Ó¦½įŹųĄäČ“ÖĮŹŅĪĀŗ󣬻ŲŹÕĘäÖŠµÄCCl
4µÄŹµŃé²Ł×÷Ćū³ĘĪŖ
¹żĀĖ
¹żĀĖ
£¬³żČ„“Ö²śĘ·ÖŠÉŁĮæÄʵďŌ¼ĮĪŖ
Ė®£Ø»ņŅŅ“¼£©
Ė®£Ø»ņŅŅ“¼£©
£®
£Ø3£©Ģ¼»¹ŌSiO
2ÖĘSiC£¬Ęä“Ö²śĘ·ÖŠŌÓÖŹĪŖSiŗĶSiO
2£®ĻÖ½«20.0g SiC“Ö²śĘ·¼ÓČėµ½¹żĮæµÄNaOHČÜŅŗÖŠ³ä·Ö·“Ó¦£¬ŹÕ¼Æµ½0.1molĒāĘų£¬¹żĀĖµĆSiC¹ĢĢå11.4g£¬ĀĖŅŗĻ”ŹĶµ½1L£®Éś³ÉĒāĘųµÄĄė×Ó·½³ĢŹ½ĪŖ
Si+2OH-+H2OØTSiO32-+2H2”ü
Si+2OH-+H2OØTSiO32-+2H2”ü
£¬¹čĖįŃĪµÄĪļÖŹµÄĮæÅضČĪŖ
0.17mol?L-1
0.17mol?L-1
£®
£Ø4£©ĻĀĮŠŠšŹöÕżČ·µÄÓŠ
¢Ū¢Ü
¢Ū¢Ü
£ØĢīŠņŗÅ£©£®
¢ŁNa»¹ŌCCl
4µÄ·“Ó¦”¢Cl
2ÓėH
2OµÄ·“Ó¦¾łŹĒÖĆ»»·“Ó¦
¢ŚĖ®¾§”¢øɱłČŪ»ÆŹ±æĖ·žĮ£×Ó¼ä×÷ÓĆĮ¦µÄĄąŠĶĻąĶ¬
¢ŪNa
2SiO
3ČÜŅŗÓėSO
3µÄ·“Ó¦æÉÓĆÓŚĶʶĻSiÓėSµÄ·Ē½šŹōŠŌĒæČõ
¢ÜÄĘ”¢ļ®·Ö±šŌŚæÕĘųÖŠČ¼ÉÕ£¬Éś³ÉµÄŃõ»ÆĪļÖŠŅõŃōĄė×ÓŹżÄæ±Č¾łĪŖ1£ŗ2£®



 £¬¹Ź“š°øĪŖ£ŗµŚ¶žÖÜĘŚµŚ¢ōA×壻Ńõ£Ø»ņO£©£»
£¬¹Ź“š°øĪŖ£ŗµŚ¶žÖÜĘŚµŚ¢ōA×壻Ńõ£Ø»ņO£©£» £»
£»

 ĆūŹ¦Öøµ¼ĘŚÄ©³å“Ģ¾ķĻµĮŠ“š°ø
ĆūŹ¦Öøµ¼ĘŚÄ©³å“Ģ¾ķĻµĮŠ“š°ø