
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | F | Ne | |||
| 3 | Na | Al | P | S | Cl |
 ;
;分析 (1)稀有气体的性质最不活泼;
(2)O的质子数为8;
(3)C元素形成的有机物化合物种类最多;
(4)非金属性越强,对应氢化物越稳定;
(5)电子层越多,原子半径越大;
(6)常温下,Fe或Al遇浓硫酸发生钝化;
(7)元素最高价氧化物对应水化物中,高氯酸的酸性最强,氢氧化钠的碱性最强.
解答 解:(1)稀有气体的性质最不活泼,则单质的化学性质最不活沷的元素是Ne,故答案为:Ne;
(2)O的质子数为8,则氧的原子结构示意图为 ,故答案为:
,故答案为: ;
;
(3)形成化合物种类最多的元素是C,故答案为:C;
(4)非金属性F>O,HF和H2O中,热稳定性较强的是HF,故答案为:HF;
(5)电子层越多,原子半径越大,则N和P中,原子半径较小的是N,故答案为:N;
(6)常温下,会在浓硫酸中发生钝化的金属是Al,故答案为:Al;
(7)元素最高价氧化物对应水化物中,碱性最强的是NaOH,酸性最强的是HClO4,故答案为:NaOH;HClO4.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置和性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 氯气与铁粉 | B. | 二氧化碳与石灰水 | ||
| C. | 锌与硫酸 | D. | 碳酸钠与硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液 | |
| B. | 将NH4Cl溶液蒸干制备NH4Cl固体 | |
| C. | 因为NH3能使酚酞溶液变红,NH3用于设计喷泉实验 | |
| D. | 浓氨水可检验氯气管道是否漏气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
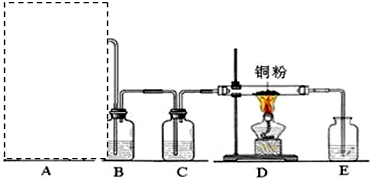
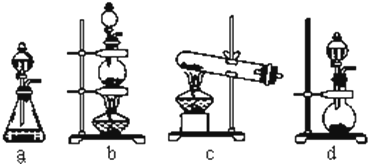
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
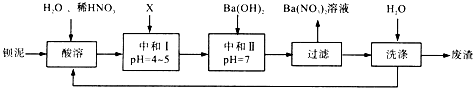
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
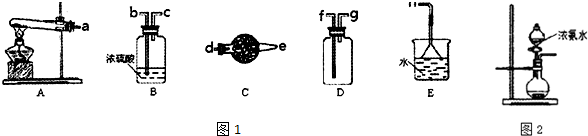
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
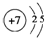 .
.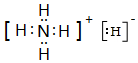 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
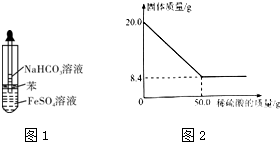
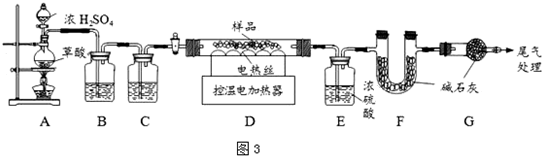
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com