
【题目】有关常温下pH均为3的醋酸和硫酸的说法正确的是( )
A.两种溶液中,由水电离出的氢离子浓度均为1×10﹣11 molL﹣1
B.分别加水稀释100倍后,两种溶液的pH仍相同
C.醋酸中的c(CH3COO﹣)和硫酸中的c(SO42﹣)相等
D.分别加入足量锌片,两种溶液生成H2的体积相同
【答案】A
【解析】A、pH均为3的醋酸和硫酸,溶液中氢离子浓度均为1×10﹣3mol/L,溶液中氢氧根浓度均为c(OH﹣)= ![]() =1×10﹣11mol/L,溶液中水电离出的氢离子浓度等于溶液中氢氧根离子的浓度,故两种溶液中,由水电离出的氢离子浓度均为1×10﹣11molL﹣1,故A符合题意;
=1×10﹣11mol/L,溶液中水电离出的氢离子浓度等于溶液中氢氧根离子的浓度,故两种溶液中,由水电离出的氢离子浓度均为1×10﹣11molL﹣1,故A符合题意;
B、硫酸是强电解质,完全电离,醋酸是弱电解质,加水稀释,醋酸继续电离出氢离子,分别加水稀释100倍后,硫酸溶液的pH值为5,醋酸溶液的pH值小于5,故B不符合题意;
C、根据电荷可知,醋酸溶液中c(H+)=c(CH3COO﹣)=1×10﹣3mol/L,硫酸溶液中c(H+)=2c(SO42﹣)=1×10﹣3mol/L,故c(SO42﹣)=5×10﹣4mol/L,故C不符合题意;
D、酸是强电解质,完全电离,醋酸是弱电解质,溶液中主要以醋酸分子存在,与足量的锌反应,醋酸提供的氢离子远远大于硫酸,锌与醋酸反应产生的氢气原大于与硫酸反应生成的氢气,故D不符合题意;
所以答案是:A.
【考点精析】掌握弱电解质在水溶液中的电离平衡是解答本题的根本,需要知道当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.


 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】甲是一种常见的单质,乙、丙为中学常见的化合物,甲、乙、丙均含有元素 X 。它们有如下的转化关系(部分产物及反应条件已略去),下列判断正确的是:
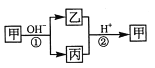
A. X元素可能为Al B. X 元素不一定为非金属元素
C.反应①和②互为可逆反应 D.反应①和②一定为氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列给定条件的溶液中,一定能大量共存的离子组是( )
A. 无色溶液:Ca2+、H+、Cl-、HSO3-
B. 能使pH试纸呈红色的溶液:Na+、NH4+、Br-、NO3-
C. FeCl2溶液:K+、、Na+、、SO42-、AlO2-
D. 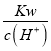 =0.1 mol/L的溶液:Na+、K+、SiO32-、NO3-
=0.1 mol/L的溶液:Na+、K+、SiO32-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列反应对应的曲线错误的是
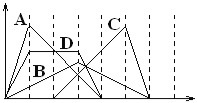
A. 向NaAlO2溶液中滴入HCl至过量
B. 向澄清石灰水中通入CO2至过量
C. 向含有盐酸的A1C13溶液中滴入NaOH溶液至过量。
D. 向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至沉淀消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,△H能正确表示物质的燃烧热的是( )
A.CO(g)+ ![]() O2(g)═CO2(g);△H=﹣283.0 kJ/mol
O2(g)═CO2(g);△H=﹣283.0 kJ/mol
B.C(s)+ ![]() O2(g)═CO(g);△H=﹣110.5 kJ/mol
O2(g)═CO(g);△H=﹣110.5 kJ/mol
C.H2(g)+ ![]() O2(g)═H2O(g);△H=﹣241.8 kJ/mol
O2(g)═H2O(g);△H=﹣241.8 kJ/mol
D.2C8H18(l)+25O2(g)═16CO2(g)+18H2O(l);△H=﹣11036 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种胃药的止酸剂为碳酸钙,测定每片中碳酸钙含量的方法有以下几步操作(设药片中的其他成分不与盐酸或氢氧化钠反应):
①配制0.100molL﹣1稀盐酸和0.100molL﹣1氢氧化钠溶液,
②取一粒药片(药片质量相同,均为0.100g),研碎后加入20.0mL蒸馏水
③以酚酞为指示剂,用0.100molL﹣1氢氧化钠溶液滴定,用去体积为V时达到终点
④加入25.00mL 0.100molL﹣1稀盐酸.
请回答下列问题
(1)测定过程的正确操作顺序为:(填序号).
(2)测定过程中发生反应的离子方程式为: .
(3)若某次实验需重复测定4次.实验室现有50mL、100mL、250mL、500mL四种规格的容量瓶,则配制稀盐酸应选用的容量瓶规格最好为 , 理由是 .
(4)某同学四次测定的V数据如表:
测定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
V/mL | 12.9 | 15.4 | 13.1 | 13.0 |
请根据这位同学的实验数据,计算药片中碳酸钙的质量分数 .
(5)下列实验操作会引起测量结果偏低的是 .
①用天平称量NaOH固体,将小烧杯放在右盘,砝码放在左盘,并移动游码,使之平衡.
②滴定前滴定管尖嘴有气泡,滴定后尖嘴气泡消失 ③中和滴定时,锥形瓶内有少量蒸馏水.④滴定管用蒸馏水洗后,未用标准液洗. ⑤读取滴定管终点读数时,仰视刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种物质是某抗生素合成过程中的中间产物,下列说法不正确的是
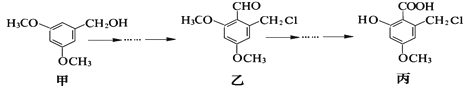
A. 乙、丙都能发生银镜反应
B. 用FeCl3溶液鉴别甲、丙两种有机化合物
C. 甲分子中所有碳原子可能共平面
D. 甲、乙、丙三种有机化合物均可与NaOH溶液发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表述正确的是( )
A. 核内质子数为117,核内中子数为174的核素Ts可表示为:174TS
B. 乙醇的结构简式:C2H6O
C. COCl2 的结构式为: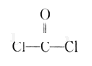
D. CaO2的电子式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化亚铜(Cu2O)是船舶防污剂的首选,可利用印刷电路板酸性蚀刻液(CuCl42-、Cl-、H+)和碱性蚀刻液[Cu(NH3)42+、NH4+、NH3、Cl-]来制备,工艺流程如下:
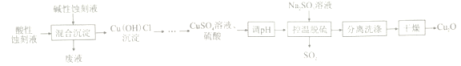
已知:强酸条件下,2Cu+==Cu+Cu2+
(1)不同pH下“混合沉淀”实验结果见下表。由表可知,pH应控制在______左右。
pH | 4.00 | 4.50 | 5.40 | 6.20 | 6.50 | 7.00 | 8.00 | 8.50 |
废液含铜量/g.L-1 | 19.5 | 2.4 | 2.0 | 0.3 | 0.2 | 2.0 | 8.3 | 17.0 |
(2)“混合沉淀”中废液的主要成分为______________(填化学式)
(3)“控温脱硫”生成Cu2O的离子方程式为_________;该过程产生的SO2经_____(填化学式)处理后生成可循环物质Na2SO3。
(4)“控温脱硫”过程中温度对Cu2O的产率影响及SO2在水中溶解度随温度变化如图所示:
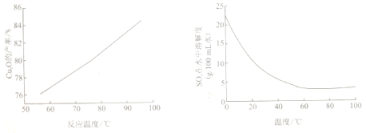
下列说法正确的是_____
a.在60℃以下,温度越高,SO2越易逸出,有利于提高生产中硫原子利用率
b.反应温度的变化是影响Cu2O产率的主要因素
c.结合工业生产实际,温度应控制在溶液呈沸腾状态
d.低温时,Cu2O产率较低与SO2低温时的溶解度较大有关
(5)检验Cu2O是否洗涤干净的方法是______________________________。
(6)某工厂用V1,L含铜量120g·L-1的酸性蚀刻液和V2L含铜量160g·L-1的碱性蚀刻液制备Cu2O,最终得到产品mg,产率为____%。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com