
| 1 |
| 2 |
| 1 |
| 2 |
| a |
| 10 |
| 7 |
| 2 |
| 7 |
| 2 |


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
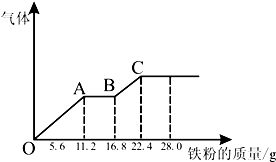 ijϡ�����ϡ����Ļ����Һ200mL��ƽ���ֳ����ݣ�������һ��������ͭ�ۣ�������ܽ�19.2g����֪����ֻ����ԭΪNO���壩������һ�����������ۣ�������������������������ӵı仯��ͼ�����з�������������ǣ�������
ijϡ�����ϡ����Ļ����Һ200mL��ƽ���ֳ����ݣ�������һ��������ͭ�ۣ�������ܽ�19.2g����֪����ֻ����ԭΪNO���壩������һ�����������ۣ�������������������������ӵı仯��ͼ�����з�������������ǣ�������| A��H2SO4Ũ��Ϊ4mol?L-1 |
| B��OA�β�������NO��AB�εķ�ӦΪFe+2Fe3+=3Fe2+��BC�β������� |
| C��ÿ�ݻ������NO3-���ʵ���Ϊ0.3mol |
| D���ڶ�����Һ����������ΪFeSO4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��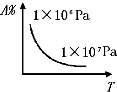 |
B�� |
C��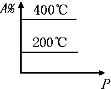 |
D��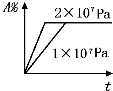 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��60 mL |
| B��45 mL |
| C��30 mL |
| D��50 mL |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
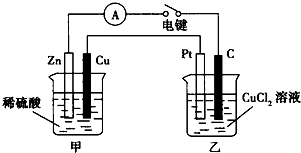 ij��ȤС���ͬѧ����ͼ��ʾװ���о��йص绯ѧ�����⣮���պϸ�װ�õĵ��ʱ���۲쵽��������ָ�뷢����ƫת��
ij��ȤС���ͬѧ����ͼ��ʾװ���о��йص绯ѧ�����⣮���պϸ�װ�õĵ��ʱ���۲쵽��������ָ�뷢����ƫת���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ˮ��Һ�У�H+��I-��ClO-��SiO32- |
| B��������Һ�У�H+��NH4+��Al3+��SO42- |
| C��������Һ�У�Na+��Al3+��AlO2-��I- |
| D��������ˮ�У�OH-��CO32-��Na+��SO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ǿ�����һ��������ˮ��������ʶ�������ˮ |
| B��NaHCO3�����ȶ��Ժ��ܽ�Ⱦ�����Na2CO3 |
| C��������ͭ��Ũ���ᷴӦ��һ���������� |
| D��Fe��S��ϼ�������FeS2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
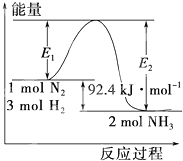 �ϳɰ���ҵ�ĺ��ķ�Ӧ�ǣ�N2��g��+3H2��g��
�ϳɰ���ҵ�ĺ��ķ�Ӧ�ǣ�N2��g��+3H2��g��| ���� |
| ���¡���ѹ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����10mL��Ͳ��ȡ8.10mLϡ���� |
| B����pH�Ʋ��ij��Һ��pHΪ2.2 |
| C����pH��ֽ�ⶨ��Һ��pHʱ������������ˮ��ʪ��ֽ |
| D������25mL��ʽ�ζ�����ȡ20.00mL KMnO4��Һ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com