
| A. | Fe2O3溶于HI溶液中:Fe2O3+6H+=2Fe3++3H2O | |
| B. | [Ag(NH3)2]OH的溶液中加入盐酸:Ag++Cl-=AgCl↓ | |
| C. | Na2S2O3溶液吸收Cl2:4Cl2+S2O32-+5H2O=10H++2SO42-+8Cl- | |
| D. | (NH4)2Fe(SO4)2溶液中加入过量NaOH溶液:NH4++Fe2++3OH-=Fe (OH)2↓+NH3•H2O |
分析 A.发生氧化还原反应生成碘化亚铁、碘、水;
B.发生OH-与酸的反应;
C.发生氧化还原反应生成硫酸钠、氯化钠;
D.加入过量NaOH溶液,亚铁离子、铵根离子均完全反应,不符合离子的配比.
解答 解:A.Fe2O3溶于HI溶液中的离子反应为2I-+Fe2O3+6H+=2Fe2++I2+3H2O,故A错误;
B.[Ag(NH3)2]OH的溶液中加入盐酸的离子反应为H++OH-=H2O,故B错误;
C.Na2S2O3溶液吸收Cl2的离子反应为4Cl2+S2O32-+5H2O=10H++2SO42-+8Cl-,遵循电子、电荷守恒,故C正确;
D.(NH4)2Fe(SO4)2溶液中加入过量NaOH溶液的离子反应为2NH4++Fe2++4OH-=Fe (OH)2↓+2NH3•H2O,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,综合性较强,题目难度不大,选项B为解答的难点.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 5种 | C. | 7种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
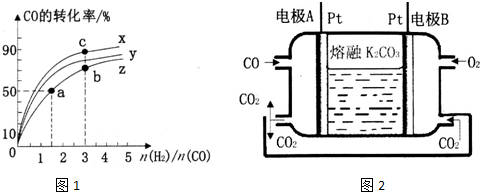
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素B在周期表中的位置为第二周期第VIA族 | |
| B. | 元素B、C、D的原子半径由大到小的顺序为r(D)>r(C)>r(B) | |
| C. | 1 mol甲与足量的乙完全反应共转移了约6.02×1023个电子 | |
| D. | 1.0L 0.lmol-L-1戊溶液中阴离子总的物质的量小于0.l mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 米酒密封储存变香的过程涉及取代反应 | |
| B. | 甲烷、氯乙烯和硝基苯都属于烃类 | |
| C. | 有机化合物均易燃烧 | |
| D. | 糖类、脂肪和蛋白质在一定条件下都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
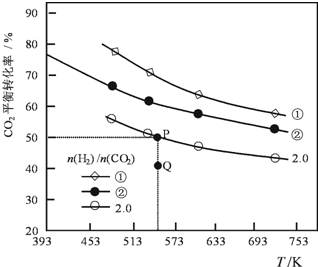 在三个容积均为1L密闭容器中以不同的氢碳比[n(H2)/n(CO2)]充入H2和CO2,在一定条件发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率与温度的关系如图所示.下列说法正确的是( )
在三个容积均为1L密闭容器中以不同的氢碳比[n(H2)/n(CO2)]充入H2和CO2,在一定条件发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率与温度的关系如图所示.下列说法正确的是( )| A. | 该反应的△H<0 | |
| B. | 氢碳比:①<② | |
| C. | 在氢碳比为2.0时,Q点v(正)<v(逆) | |
| D. | 若起始时,CO2、H2浓度分别为0.5mol•L-1和1.0mol•L-1,则可得P点对应温度的平衡常数的值为512 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe$\stackrel{Cl_{2}}{→}$FeCl3$\stackrel{Fe}{→}$FeCl2 | B. | Cu$\stackrel{S}{→}$CuS$\stackrel{HCl}{→}$ CuCl2 | ||
| C. | CO2 $\stackrel{Mg}{→}$C$\stackrel{SiO_{2}}{→}$ CO | D. | NO2 $\stackrel{H_{2}O}{→}$NO$\stackrel{NH_{3}}{→}$ N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂在酸性条件下水解生成高级脂肪酸和甘油 | |
| B. | 用溴水鉴别苯和正己烷 | |
| C. | 乙醇、糖类和蛋白质都是人体必需的营养物质 | |
| D. | 合成橡胶与光导纤维都属于有机高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤⑦ | B. | ②⑤⑥⑧ | C. | ①③④⑦ | D. | ③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com