
| 氟 | 氯 | 溴 | 碘 | 铍 | |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
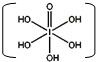 和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6
和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6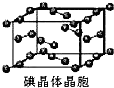 A、用均摊法可知平均每个晶胞中有4个碘原子
A、用均摊法可知平均每个晶胞中有4个碘原子 )中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO4为一元酸,含有1个羟基氢,含非羟基氧原子3个,所以酸性:H5IO6<HIO4,
)中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO4为一元酸,含有1个羟基氢,含非羟基氧原子3个,所以酸性:H5IO6<HIO4,| 7+1-2×2 |
| 2 |


科目:高中化学 来源: 题型:
| A、用润湿的pH试纸测定饱和Na2CO3溶液的pH |
| B、向同pH、同体积的醋酸和盐酸溶液中加入足量镁粉,通过完全反应后收集到的H2体积比较两种酸的电离程度:醋酸<盐酸 |
| C、将1mLKSCN溶液与1mL同浓度FeCl3溶液充分混合;再继续加入KSCN溶液,溶液颜色加深.证明溶液中存在平衡:Fe3++3SCN-═Fe(SCN)3 |
| D、在中和热测定的实验中,将NaOH溶液和盐酸混合反应后的冷却温度作为终点温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向溶液X中滴加盐酸无明显现象,再滴加BaCl2溶液有白色沉淀,则X中含有SO42- |
| B、向NaAlO2溶液中滴入NaHCO3溶液有白色沉淀,则AlO2-结合H+能力比CO32-强 |
| C、向1 mL 1% NaOH溶液加入2 mL 2%的CuSO4溶液,振荡后滴加0.5 mL5%葡萄糖溶液,加热,未出现红色沉淀.证明葡萄糖中不含醛基 |
| D、检验某补铁药片(主要成分为亚铁化合物)是否氧化变质,使用氯水和硫氰化钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
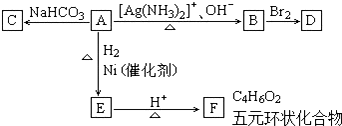
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C、CO |
| B、AlCl3、Al(OH)3 |
| C、Fe、Fe(NO3)2 |
| D、S、SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、对于可逆反应来说,反应物只有按等物质的量投料,其转化率才能相等 |
| B、AgCl悬浊液中存在平衡:AgCl(s)?Ag+ (aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度会减小 |
| C、常温下0.1 mol/L的下列溶液 ①NH4Al(SO4)2、②NH4Cl、③NH3?H2O、④CH3COONH4中c (NH4+)由大到小的顺序是:②>①>④>③ |
| D、等浓度的下列稀溶液:①硫酸氢钠、②乙酸钠、③醋酸、④碳酸氢钠、⑤硝酸钠、⑥苯酚钠,它们的PH由小到大排列的为:①③⑤②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、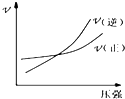 如图:反应N2+3H2?2NH3在恒温情况下,反应速率与压强的关系 |
B、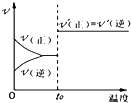 如图:反应H2+I2?2HI 达平衡后,升高温度时反应速率随时间的变化 |
C、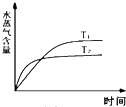 如图:反应CO2(g)+H2(g)?CO(g)+H2O(g)△H>0,水蒸气含量随时间的变化 |
D、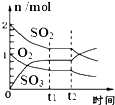 如图:反应2SO2+O2?2SO3 达平衡后,缩小容器体积时各成分的物质的量随时间的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、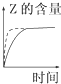 |
B、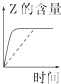 |
C、 |
D、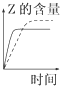 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该物质可能是金属钠 |
| B、该物质一定含钠元素 |
| C、该物质中可能含钾元素 |
| D、该物质一定是钠的化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com