
(12分)A、B、C、D 四种主族元素原子序数均在20以内,A元素所处的周期数、主族序数、原子序数均相等,B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3 ,C元素原子的最高正价为+6价,C的阴离子与D的阳离子具有相同的电子排布,D可与C形成化合物D2C。
(1)D元素的名称_______;B在周期表中的位置:第_______周期第_______族
(2)A、B形成的化合物以_______共价键相结合(填极性或非极性)
(3)以C的最高价氧化物对应的水化物作为电解质溶液,组成氢氧燃料电池,放电时则负极区溶液的pH_______(填增大、减小、不变)
(4)以D的最高价氧化物对应的水化物作为电解质溶液,组成氢氧燃料电池,则正极的电极反应式为_____________________
(5)A、B、C、D四种元素简单离子的离子半径由大到小的顺序是(用离子符号表示) ____________________________
(6)C的质子数和中子数相等,则C 的原子组成符号为_______它形成的氢化物的还原性_______氯化氢(填强于或弱于)
(1)钾 二 ⅤA (各1分,共3分)
(2)极性 (1分)
(3)减小 (1分)
(4)O2 + 2H2O + 4e- = 4OH- (2分)
(5)S2- > K+ > N3- > H+ (2分)
(6)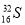 (2分)
(2分)
强于 (1分)
【解析】
试题分析:A元素所处的周期数、主族序数、原子序数均相等,应为H元素,B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3,则B为第二周期第ⅤA族,为N元素;C元素原子的最外层电子数比次外层少2个,应为S元素,C的阴离子与D的阳离子具有相同的电子层结构,两元素可形成化合物D2C,则D为K元素
D为钾元素,B为N元素,原子序数为7,原子核外有2个电子层,最外层电子数位5,则位于第二周期第ⅤA族,
A是H,B是N,两者都是非金属元素,但两者原子核外电子不同原子半径不同,形成的化学键应为极性共价键。
C为S,其最高价氧化物对应的水化物是硫酸,组成氢氧燃料电池,负极:2H2 -4e- = 4H+;正极:O2 + 4e- + 4H+ = 2H2O;总:2H2+ O2= 2H2O 。负极氢离子不断的增加,PH减小
D为K,最高价氧化物的水化物是氢氧化钾,碱性条件下
负极:2H2+4OH- - 4e-=4H2O 正极:O2+4e-+2H2O=4OH-
同主族元素,随着原子序数增大,离子半径逐渐变大;同周期元素,随着原子序数增大,离子半径逐渐变小。具有相同电子层结构的离子,原子序数越大,离子半径越小。
C元素原子的最高正价为+6价,C的阴离子与D的阳离子具有相同的电子排布,D可与C形成化合物D2C,且C的质子数和中子数相等,所以C为S,同周期元素,氯的非金属性强于硫,所以氯化氢的稳定性强于硫化氢。
考点:考查元素周期表、元素周期律、原电池、离子半径等相关知识。


科目:高中化学 来源:2013-2014天津市南开区高三二模试卷理综化学试卷(解析版) 题型:简答题
(14分)化学在能源开发与利用中起着十分重要的作用。
(1)蕴藏在海底的可燃冰是高压下形成的外观像冰的甲烷水合物固体.被称之为“未来能源”。在25℃、101 kPa下,1g甲烷完全燃烧生成和液态水时放热55.6 kJ。甲烷燃烧的热化学方程式为 ______:相同条件下,356 g可燃冰(分子式为CH4·9H2O,Mr=178)释放的甲烷气体完全燃烧生成CO2和液态水,放出的热量为_______kJ。
(2)二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,具有清洁、高效的优良性能。由合成气(组成为H2、CO和少量的CO2)直接制各二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:
(Ⅰ)CO(g)+2H2(g)═CH3OH(g) △H1=-90.1kJ?mol-1
(Ⅱ)CO2(g)+3H2(g)═CH3OH(g)+H2O(g) △H2=-49.0kJ?mol-1
水煤气变换反应:(Ⅲ)CO(g)+H2O(g)═CO2(g)+H2 (g) △H3=-41.1kJ?mol-1
二甲醚合成反应:(Ⅳ)2CH3OH(g)═CH3OCH3(g)+H2O(g)△H4=-24.5kJ?mol-1
①分析二甲醚合成反应(iv)对于CO转化率的影响___________________________________。
②由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为:__________________。根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响_________________________________。
(3)二甲醚直接燃料电池具有启动快、效率高等优点。若电解质为碱性,二甲醚直接燃料电池的负极反应为______________________,一个二甲醚分子经过电化学氧化,可以产生________电子的电量。
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市东丽区第一学期期末质量监测高一年级化学试卷(解析版) 题型:选择题
下列说法正确的是
A.能电离出H+的物质属于酸
B.盐类物质中一定含有金属离子
C.过氧化氢与二氧化硫的漂白原理相同
D.胶体与其它分散系的本质区别是分散质粒子直径的不同
查看答案和解析>>
科目:高中化学 来源:2013-2014天津五区县高二下学期期末考试化学试卷(解析版) 题型:选择题
下列关于有机化合物的认识不正确的是
A.盐析可提纯蛋白质并保持其生理活性
B.蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体
C.石油分馏可获得乙烯、丙烯和丁二烯
D.向澄清的苯酚钠溶液中通入二氧化碳气体,会看到澄清溶液变浑浊
查看答案和解析>>
科目:高中化学 来源:2013-2014天津五区县高二下学期期末考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.光导纤维、棉花、油脂、ABS树脂都是由高分子化合物组成的物质
B.推广基础甲醇汽油,使用无磷洗涤剂都可直接降低碳排放
C.动植物蛋白质混合摄入,能增强蛋白质的营养作用
D.汽车催化转化器不会降低汽车尾气污染物向大气中排放
查看答案和解析>>
科目:高中化学 来源:2013-2014天津五区县高一下学期期末考试化学试卷(解析版) 题型:选择题
某同学做完铜、锌稀硫酸原电池的实验后得出了下列结论,你认为正确的是
A.构成原电池正极和负极的材料必须是两种金属
B.当由铜、锌电极与硫酸铜溶液组成原电池时,铜是负极
C.该实验电子沿导线由锌流向铜,氢离子得到电子而放出氢气
D.铜锌原电池工作时,电流由锌经导线流向铜
查看答案和解析>>
科目:高中化学 来源:2013-2014天津五区县高一下学期期末考试化学试卷(解析版) 题型:选择题
下列各组液体混合物,能用分液漏斗分离的是
A.乙酸和水B.液溴和苯
C.苯和水D.乙醇和水
查看答案和解析>>
科目:高中化学 来源:2013-2014四川绵阳中学实验学校高考冲刺理综化学试卷(解析版) 题型:选择题
下列实验能达到预期目的的是 ( )
编号 | 实验内容 | 实验目的 |
A | 室温下,用pH试纸分别测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
B | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
C | 向10mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/LFeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp: Mg(OH)2 >Fe(OH)3 |
D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 | 证明非金属性S>C |
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省下学期期中考试高二化学试卷(解析版) 题型:选择题
某原电池总反应离子方程式为2Fe3++Fe===3Fe2+,能实现该反应的原电池是( )
A.正极为Cu,负极为Fe,电解质溶液为Fe(NO3)2溶液
B.正极为Cu,负极为Fe,电解质溶液为FeCl3溶液
C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液
D.正极为Ag,负极为Fe,电解质溶液为CuSO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com