
| A��0.1 mol?L?1NH4Cl��Һ��KW����0.01mol?L?1NH4Cl��Һ��KW |
| B������ͭ����Ʒ�Ʋ����������Ʒ������ǰ���������� |
C��N2(g)+3H2(g) 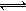 2NH3(g) ��H<0��������������ʱ�������¶ȣ���Ӧ����v(H2)��H2��ƽ��ת���ʦ�(H2)������ 2NH3(g) ��H<0��������������ʱ�������¶ȣ���Ӧ����v(H2)��H2��ƽ��ת���ʦ�(H2)������ |
| D��ˮ�����ӻ�����Kw �����¶ȵ����߶�����˵��ˮ�ĵ����Ƿ��ȷ�Ӧ |


 ͬ����ϰ���ϴ�ѧ������ϵ�д�
ͬ����ϰ���ϴ�ѧ������ϵ�д� ͬ����ϰ����ʦ����ѧ������ϵ�д�
ͬ����ϰ����ʦ����ѧ������ϵ�д� ����ϰ�⽭��ϵ�д�
����ϰ�⽭��ϵ�д� ѧ���쳵��������������������ϵ�д�
ѧ���쳵��������������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������Ȼ���д��ڵĵ��ʣ�һ���߱���ѧ�����ȶ��������������ʷ�����Ӧ��һ���� |
| B��100����ǰ��Ӣ�����ľ��ʸĽ���¯����ͼ�ӳ�CO��Fe2O3�ĽӴ�ʱ�䣬�Լ���CO���ŷţ���Υ���˻�ѧ��Ӧ����һ������һ����ԭ�� |
| C������Һ�У���ɫ���ʲ���ķ�Ӧ�������÷ֹ��ȼ����ⶨ�仯ѧ��Ӧ���� |
| D����Ȼ̼��Ʒֽ���Ҫ���մ������ȣ����ڸ���������Ҳ���Է����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��HCl��g��+NH3��g���� NH4Cl��s�� |
| B��2KClO3��s����2KCl��s��+3O2��g�� |
| C��2Na2O2��s��+2H2O��l����4NaOH��s��+O2��g�� |
| D��Ba��OH��2��8H2O��s��+2NH4Cl��s����BaCl2��s��+ 2NH3��g��+10H2O��l�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 C(g)+3D(g)�ڸ���ʱ���Է����У����淴Ӧ�ڵ��������Է����У���÷�Ӧ�ġ�H����SӦΪ
C(g)+3D(g)�ڸ���ʱ���Է����У����淴Ӧ�ڵ��������Է����У���÷�Ӧ�ġ�H����SӦΪ| A����H��0����S��0 | B����H��0����S��0 | C����H��0����S��0 | D����H��0����S��0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����ڻ����409K | B������136K |
| C������136K���ҵ���409K | D�������¶� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 C(g)+D(g)���������������������仯ʱ���ܱ����÷�Ӧһ���ﵽƽ��״̬���ǣ� ��
C(g)+D(g)���������������������仯ʱ���ܱ����÷�Ӧһ���ﵽƽ��״̬���ǣ� ��| A��A�����ʵ���Ũ�� | B���������������ʵ��� |
| C�������������ѹǿ | D�����������ܶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 CH3OH(g)��6��ʱ��ϵ�ﵽƽ�⣬��ʱ������ѹǿΪ��ʼʱ��0.6����
CH3OH(g)��6��ʱ��ϵ�ﵽƽ�⣬��ʱ������ѹǿΪ��ʼʱ��0.6�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ˮ�ɸߴ���ʹ��� | B��ˮ��ɱ� |
| C��CaCO3�ֽ�ΪCaO��CO2 | D��ʯīת��Ϊ���ʯ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������ȷ�Ӧ�� |
| B���Ƿ��ȷ�Ӧ�� |
| C�����ؼ��ٵķ�Ӧ�� |
| D��������ЧӦ��������ЧӦ�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com