
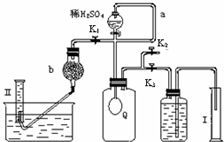
(12分)、过碳酸钠(Na2CO4)在洗涤、印染、造纸、医药卫生等领域有大量应用。
已知:过碳酸钠与硫酸溶液反应的化学方程式如下: Na2CO4 +H2SO4 →Na2SO4 +H2O2 + CO2↑ 2H2O2 →2H2O+ O2↑.为测定已变质的过碳酸钠(含碳酸钠)的纯度,设计如图所示的实验:Q为—具有良好的弹性的气球(不与反应物和生成物反应),称取一定量的样品和少量二氧化锰放于其中,按图安装好实验装置,打开分液漏斗的活塞,将稀H2SO4滴入气球中。

⑴Q内发生反应生成的气体为__________,导管a作用是 。
⑵为测出反应时生成气体的总体积,滴稀H2SO4前必须关闭K1、K2,打开K3。当上述反应停止,将K1、K2、K3处于关闭状态,然后先打开K2,再缓缓打开K1,这时可观察到的现象是_________ _____,b中装的碱石灰的作用是__________________。
⑶实验结束时,量筒I中有xmL水,量筒Ⅱ中收集到ymL气体(上述体积均已折算到标准状况),则过碳酸钠的纯度是____________
⑷某同学实验测得的过碳酸钠的纯度超过100%,你认为可能的原因是_______
A.气体滞留在Q和导气管中,未全部进入量筒Ⅱ
B.量筒Ⅱ读数时,量筒液面高于水槽液面
C.右侧量筒Ⅰ和储液集气瓶连接导管内的液体没有计入读数x
D.气体体积数值x、y没有扣除滴加的硫酸的体积
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
 过碳酸钠(Na2CO4)在洗涤、印染、造纸、医药卫生等领域有大量应用.
过碳酸钠(Na2CO4)在洗涤、印染、造纸、医药卫生等领域有大量应用.| 12200y |
| 53x+69y |
| 12200y |
| 53x+69y |
查看答案和解析>>
科目:高中化学 来源: 题型:
 过碳酸钠(Na2CO4)在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用.
过碳酸钠(Na2CO4)在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)、过碳酸钠(Na2CO4)在洗涤、印染、造纸、医药卫生等领域有大量应用。
已知:过碳酸钠与硫酸溶液反应的化学方程式如下: Na2CO4 +H2SO4 →Na2SO4 +H2O2 + CO2↑ 2H2O2 →2H2O+ O2↑.为测定已变质的过碳酸钠(含碳酸钠)的纯度,设计如图所示的实验:Q为—具有良好的弹性的气球(不与反应物和生成物反应),称取一定量的样品和少量二氧化锰放于其中,按图安装好实验装置,打开分液漏斗的活塞,将稀H2SO4滴入气球中。
⑴Q内发生反应生成的气体为__________,导管a作用是 。
⑵为测出反应时生成气体的总体积,滴稀H2SO4前必须关闭K1、K2,打开K3。当上述反应停止,将K1、K2、K3处于关闭状态,然后先打开K2,再缓缓打开K1,这时可观察到的现象是_________ _____,b中装的碱石灰的作用是__________________。
⑶实验结束时,量筒I中有xmL水,量筒Ⅱ中收集到ymL气体(上述体积均已折算到标准状况),则过碳酸钠的纯度是____________
⑷某同学实验测得的过碳酸钠的纯度超过100%,你认为可能的原因是_______
A.气体滞留在Q和导气管中,未全部进入量筒Ⅱ
B.量筒Ⅱ读数时,量筒液面高于水槽液面
C.右侧量筒Ⅰ和储液集气瓶连接导管内的液体没有计入读数x
D.气体体积数值x、y没有扣除滴加的硫酸的体积
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省高三上学期期中考试化学试卷 题型:实验题
(12分)过碳酸钠(Na2CO4)在洗涤、印染、造纸、医药卫生等领域有大量应用。
已知:过碳酸钠与硫酸溶液反应的化学方程式如下: Na2CO4 +H2SO4 →Na2SO4 +H2O2 + CO2↑ 2H2O2 →2H2O+ O2↑.为测定已变质的过碳酸钠(含碳酸钠)的纯度,设计如图所示的实验:Q为—具有良好的弹性的气球(不与反应物和生成物反应),称取一定量的样品和少量二氧化锰放于其中,按图安装好实验装置,打开分液漏斗的活塞,将稀H2SO4滴入气球中。
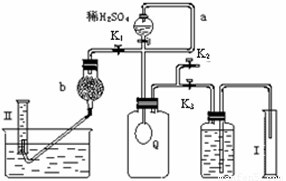
⑴Q内发生反应生成的气体为__________,导管a作用是 。
⑵为测出反应时生成气体的总体积,滴稀H2SO4前必须关闭K1、K2,打开K3。当上述反应停止,将K1、K2、K3处于关闭状态,然后先打开K2,再缓缓打开K1,这时可观察到的现象是_________ _____,b中装的碱石灰的作用是__________________。
⑶实验结束时,量筒I中有xmL水,量筒Ⅱ中收集到ymL气体(上述体积均已折算到标准状况),则过碳酸钠的纯度是____________
⑷某同学实验测得的过碳酸钠的纯度超过100%,你认为可能的原因是_______
A.气体滞留在Q和导气管中,未全部进入量筒Ⅱ
B.量筒Ⅱ读数时,量筒液面高于水槽液面
C.右侧量筒Ⅰ和储液集气瓶连接导管内的液体没有计入读数x
D.气体体积数值x、y没有扣除滴加的硫酸的体积
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com