
| A.氯酸钾溶液 | B.溴化钠溶液? |
| C.氯乙烷 | D.氯仿和碱溶液煮沸后的溶液 |
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| B | AgI沉淀中滴入稀KCl溶液 | 有白色沉淀出现 | AgCl比AgI更难溶 |
| C | 常温下,向饱和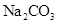 溶液中加少量 溶液中加少量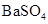 粉末,过滤,向洗净的沉淀中加稀盐酸 粉末,过滤,向洗净的沉淀中加稀盐酸 | 有气泡产生 | 不能说明常温下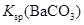 与 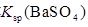 的大小关系 的大小关系 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在托盘天平上放两张大小相等的纸片,然后将NaOH固体放在纸片上进行称量 |
| B.把称得的NaOH放入适量蒸馏水的烧杯中,溶解、冷却,再把溶液移入容量瓶中 |
| C.用蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液也移入容量瓶中 |
| D.距刻度1—2cm时,用胶头滴管加入蒸馏水,直到液体凹面最低点恰好与刻度相切 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.制取蒸馏水时,为防止烧瓶内产生暴沸现象,应事先向烧瓶中加入几片碎瓷片 |
| B.测定未知NaOH溶液浓度时,酸式滴定管需用标准酸液润洗2—3次 |
| C.配制0.1mol/L的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释 |
| D.燃着的酒精灯不慎碰翻失火,应立即用湿布盖灭 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 、乙两个充满氧气的密闭容器中各加入一定量的碳粉,在高温条件下使其充分反应,待反应结束后,两个容器中的碳粉都已完全消失。该小组成员对反应后两容器内气体进行如下探究:
、乙两个充满氧气的密闭容器中各加入一定量的碳粉,在高温条件下使其充分反应,待反应结束后,两个容器中的碳粉都已完全消失。该小组成员对反应后两容器内气体进行如下探究: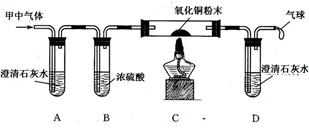
 行步骤2的实验,其理由是 。
行步骤2的实验,其理由是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
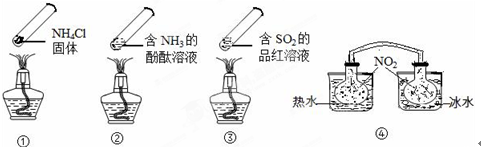
| A.加热时,①上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好 |
| B.加热时,②、③溶液均变红,冷却后又都变为无色 |
| C.④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅 |
| D.四个“封管实验”中所发生的化学反应都是可逆反应 |
| (1) | 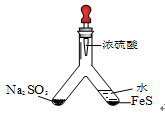 | 实验目的:验证SO2有氧化性 将胶头滴管中浓硫酸分别滴入Y型管的两个支管中,在支管交叉处实验现象为________________;硫化亚铁处加水的目的是___________________。 |
| (2) | 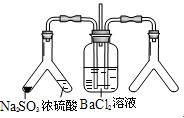 | 实验目的:探究SO2与BaCl2反应产生沉淀的条件 二氧化硫通入氯化钡溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀。则右侧Y型管中应放置的药品是_________、_________(必要时可以加热),该沉淀的化学式为____________。 |
| (3) | 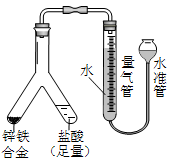 | 实验目的:锌铁合金中铁含量的测定 ①读取量气管中数据时,若发现水准管中的液面低于量气管中液面,应采取的措施是__________ _________________________________________。  ②若称得锌铁合金的质量为0.117g,量气管中初读数为1. 00mL,末读数为45.80mL,则合金中铁的含量为________%(保留2位小数,气体读数已折算成标准状况下的数值)。 ②若称得锌铁合金的质量为0.117g,量气管中初读数为1. 00mL,末读数为45.80mL,则合金中铁的含量为________%(保留2位小数,气体读数已折算成标准状况下的数值)。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.冷却至室温后,在100mL容量瓶中定容配成100mL稀硫酸。 |
| B.量取20.00mL稀硫酸于锥形瓶中并滴入几滴指示剂。 |
C.将酸式滴定管和碱式滴定管 用蒸馏水洗涤干净,并用各待盛溶液润洗。 用蒸馏水洗涤干净,并用各待盛溶液润洗。 |
| D.将物质的量浓度为1.50mol·L-1标准NaOH溶液装入碱式滴定管,调节液面记下读数V1。 |
| 滴定 序号 | 待测稀硫酸 的体积(mL) | 所消耗NaOH标准溶液液的体积(mL) | |
| V1 | V2 | ||
| ① | 20.00 | 0.50 | 22.60 |
| ② | 20.00 | 6.00 | 27.90 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com