
| X气体 | Y溶液 | 预测的现象 | 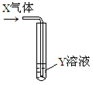 | |
| ① | CO2 | 饱和CaCl2溶液 | 白色沉淀析出 | |
| ② | SO2 | Ba(NO3)2溶液 | 白色沉淀析出 | |
| ③ | NH3 | AgNO3溶液 | 白色沉淀析出 | |
| ④ | NO2 | Na2S溶液 | 白色沉淀析出 |
| A. | 只有①②③ | B. | 只有①② | C. | 只有② | D. | ②④ |
分析 ①盐酸的酸性大于碳酸;
②SO2与Ba(NO3)2溶液发生氧化还原反应;
③NH3与AgNO3溶液反应,先生成沉淀后生成银氨溶液;
④NO2与Na2S溶液发生氧化还原反应生成S.
解答 解:①盐酸的酸性大于碳酸,可知二氧化碳与氯化钙不反应,无现象,故错误;
②SO2与Ba(NO3)2溶液发生氧化还原反应,生成硫酸钡白色沉淀,故正确;
③NH3与AgNO3溶液反应,先生成沉淀后生成银氨溶液,则先生成沉淀后沉淀消失,故错误;
④NO2与Na2S溶液发生氧化还原反应生成S,则有淡黄色沉淀生成,故错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应与现象、实验技能为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol/L的CH3COOH溶液和0.1mol/L的CH3COOH溶液,水的电离程度前者大于后者 | |
| B. | pH=2的HA溶液和pH=12的NaOH溶液等体积混合后溶液显碱性,则混合后的溶液中存在平衡:A-+H2O?HA+OH- | |
| C. | 已知同浓度的NaA、NaB、NaX溶液碱性逐渐增强,则Ks(HA)<Ks(HB)<Ks(HX) | |
| D. | 已知常温下AgCl的Ksp=1.56×10-10,则浓度均为2.2×10-5mol/L的AgNO3溶液、NaCl溶液等体积混合,会产生AgCl白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
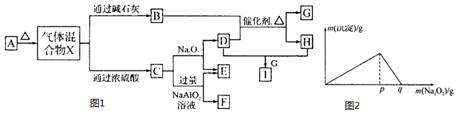
| I溶液的体积(mL) | 4 | 8 | 15 | 20 | 50 | 120 | 150 |
| C的体积(mL) | 0 | 0 | 112 | 224 | 896 | 2240 | 2240 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
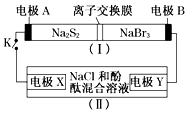 如图所示,装置(Ⅰ)是一种可充电电池的示意图,装置(Ⅱ)为电解池的示意图;装置(Ⅰ)的离子交换膜只允许Na+通过.电池充、放电的化学方程式为:2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr.当闭合K时,X极附近溶液先变红色.下列说法正确的是( )
如图所示,装置(Ⅰ)是一种可充电电池的示意图,装置(Ⅱ)为电解池的示意图;装置(Ⅰ)的离子交换膜只允许Na+通过.电池充、放电的化学方程式为:2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr.当闭合K时,X极附近溶液先变红色.下列说法正确的是( )| A. | 装置(Ⅰ)中Na+从左到右通过离子交换膜 | |
| B. | A电极的电极反应式为NaBr3+2Na++2e-═3NaBr | |
| C. | X电极的电极反应式为2Cl--2e-═Cl2↑ | |
| D. | 每有0.1 mol Na+通过离子交换膜,X电极上就析出标准状况下的气体1.12 L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com