
|
甲醚(CH3OCH3)和乙醇(CH3CH2OH)分子式相同,是同分异构体,但乙醇的沸点比甲醚高,其原因是 | |
| [ ] | |
A. |
乙醇的相对分子质量比甲醚大 |
B. |
乙醇分子内化学键牢固 |
C. |
乙醇分子间形成了氢键 |
D. |
乙醇分子在水溶液中电离出OH- |
科目:高中化学 来源: 题型:
下列叙述中不正确的是( )
A.利用核磁共振分析可以辨别甲醚(CH3OCH3)和乙醇
B.利用丁达尔效应可以区分淀粉溶液与葡萄糖溶液
C.在一定温度下,对于任何两种难溶电解质,Ksp大的电解质的溶解度也一定大
D. ΔH>0、ΔS<0的反应在任何温度下都不能自发进行
查看答案和解析>>
科目:高中化学 来源:2012届湖北省普通高等学校招生5月适应性考试化学试卷(带解析) 题型:填空题
(14分)二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下: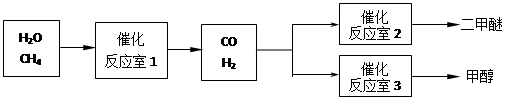
请填空:
(1)在一定条件下,反应室1中发生反应:CH4(g)+H2O(g)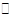 CO(g)+3H2(g) △H>0。
CO(g)+3H2(g) △H>0。
在其它条件不变的情况下降低温度,逆反应速率将 (填“增大”、“减小”或“不变”)。将1.0molCH4和2.0molH2O通入反应室1(假设容积为10L),1min末有0.1molCO生成,则1min内反应的平均速率v(H2)= mol·L-1·min-1。
(2)在一定条件下,已知反应室2的可逆反应除生成二甲醚外还生成了气态水,其化学方程式为 。
(3)在压强为0.1MPa条件下,反应室3(容积为2L)中 0.2molCO与0.4molH2在催化剂作用下反应生成甲醇:CO(g)+2H2(g) CH3OH(g),CO的平衡转化率与温度、压强的关系如右图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如右图所示,则: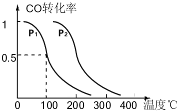
①P1 P2 (填“<”、“>”或“=”)。
②在P1压强下,100℃时,反应CO(g)+2H2(g)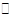 CH3OH(g)的平衡常数K的值为
CH3OH(g)的平衡常数K的值为
若温度不变,再加入1.0molCO后重新达到平衡,则CO的转化率 (填“增大”、“不变”或“减小”),CH3OH的体积分数 (填“增大”、“不变”或“减小”)。
③在其它条件不变的情况下,反应室3再增加0.2molCO与0.4molH2,达到新平衡时,CO的转化率 (填“增大”、“不变”或“减小”),c(CH3OH) 0.1mol/L(填“>”、“<”或“ = ”)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题冲刺第5讲 化学反应与能量练习卷(解析版) 题型:填空题
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
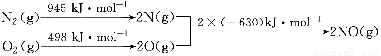
写出该反应的热化学方程式:________________。
(2)二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:
(ⅰ)CO(g)+2H2(g)=CH3OH(g)ΔH1=-90.1 kJ·mol-1
(ⅱ)CO2(g)+3H2(g)=CH3OH(g)+H2O(g)ΔH2=-49.0 kJ·mol-1
水煤气变换反应:
(ⅲ)CO(g)+H2O(g)=CO2(g)+H2(g)ΔH3=-41.1 kJ·mol-1
二甲醚合成反应:
(ⅳ)2CH3OH(g)=CH3OCH3(g)+H2O(g)ΔH4=-24.5 kJ·mol-1
由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为_______________。
根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响_________________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年湖北省招生5月适应性考试化学试卷(解析版) 题型:填空题
(14分)二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:

请填空:
(1)在一定条件下,反应室1中发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)
△H>0。
CO(g)+3H2(g)
△H>0。
在其它条件不变的情况下降低温度,逆反应速率将 (填“增大”、“减小”或“不变”)。将1.0molCH4和2.0molH2O通入反应室1(假设容积为10L),1min末有0.1molCO生成,则1min内反应的平均速率v(H2)= mol·L-1·min-1。
(2)在一定条件下,已知反应室2的可逆反应除生成二甲醚外还生成了气态水,其化学方程式为 。
(3)在压强为0.1MPa条件下,反应室3(容积为2L)中
0.2molCO与0.4molH2在催化剂作用下反应生成甲醇:CO(g)+2H2(g) CH3OH(g),CO的平衡转化率与温度、压强的关系如右图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如右图所示,则:

① P1 P2 (填“<”、“>”或“=”)。
②在P1压强下,100℃时,反应CO(g)+2H2(g) CH3OH(g)的平衡常数K的值为
CH3OH(g)的平衡常数K的值为
若温度不变,再加入1.0molCO后重新达到平衡,则CO的转化率 (填“增大”、“不变”或“减小”),CH3OH的体积分数 (填“增大”、“不变”或“减小”)。
③在其它条件不变的情况下,反应室3再增加0.2molCO与0.4molH2,达到新平衡时,CO的转化率 (填“增大”、“不变”或“减小”),c(CH3OH) 0.1mol/L(填“>”、“<”或“ = ”)
查看答案和解析>>
科目:高中化学 来源:2010年江苏省高二第二学期期末考试化学试题 题型:选择题
上海作为2010年世博会的举办城市,公共交通的“绿色”也已经在进行。二甲醚(CH3OCH3)被称为21世纪的新型燃料,清洁、高效,有优良的环保性能,以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。有关说法正确的是
A.二甲醚与乙醇是同分异构体
B.该燃料电池中通入二甲醚的一极为正极
C.二甲醚作为汽车燃料不会产生氮的氧化物和碳氢化合物的污染
D.在燃料电池中二甲醚最终转化为CO2和H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com