
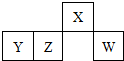
 下表为元素周期表的一部分,X、Y、Z、W均为短周期元素,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
下表为元素周期表的一部分,X、Y、Z、W均为短周期元素,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )| A. | 最高价氧化物对应水化物的酸性Y>Z>W | |
| B. | WO2可使酸性高锰酸钾褪色,说明WO2有漂白性 | |
| C. | ZCl4电子式: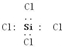 | |
| D. | X的气态氢化物可与W的最高价氧化物对应水化物相互反应生成离子化合物 |
分析 由短周期元素在周期表中的位置可知,X处于第二周期,Y、Z、W处于第三周期,W原子的最外层电子数是最内层电子数的3倍,最外层电子数为6,则W为S,可推知X为N,Y为Al,Z为Si,结合元素周期律及其单质化合物的性质来解答.
解答 解:由短周期元素在周期表中的位置可知,X处于第二周期,Y、Z、W处于第三周期,W原子的最外层电子数是最内层电子数的3倍,最外层电子数为6,则W为S,可推知X为N,Y为Al,Z为Si,
A.非金属性S>Si>Al,非金属性越强,对应的最高价氧化物的酸性越强,故A错误;
B.SO2可使酸性高锰酸钾褪色,说明SO2具有还原性,漂白性无关,故B错误;
C.Cl原子未成键的孤对电子未画出,四氯化硅的电子式为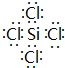 ,故C错误;
,故C错误;
D.X的气态氢化物为氨气,W的最高价氧化物对应水化物为硫酸,二者反应生成硫酸铵,属于离子化合物,故D正确.
故选D.
点评 本题考查结构性质位置关系应用,W为推断的突破口,熟练掌握元素周期表与元素周期律,题目难度中等.


 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲烷 | B. | 乙烷 | C. | 丙烷 | D. | 丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
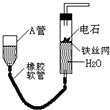 如图的实验装置可用于实验室中制取乙炔及成份检验.请回答下列问题:
如图的实验装置可用于实验室中制取乙炔及成份检验.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | CuSO4 | C. | H2SO4 | D. | Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液和CuCl2溶液 | B. | Na2SO4溶液和NaCl溶液 | ||
| C. | AlCl3溶液和NaOH溶液 | D. | 盐酸溶液和Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷的比例模型是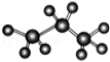 | |
| B. | C2H4 与C3H6一定互为同系物 | |
| C. | 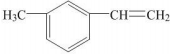 属于芳香烃 属于芳香烃 | |
| D. | 羟基的电子式为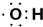 ,1 mol-OH 含有7 mol 电子 ,1 mol-OH 含有7 mol 电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com