
【题目】下列物质间的转化通过—步反应不能实现的是
A.CO2→Na2CO3 B.FeCl3→FeCl2
C.H2SiO3→Na2SiO3 D.S→SO3
科目:高中化学 来源: 题型:
【题目】高一入学体检时,某同学体检的血液化验单中,出现了如下图所示的体检指标。表示该体检指标的物理量是( )
甘油三酯 | 0.52 | mmol/L |
总胆固醇 | 4.27 | mmol/L |
高密度脂蛋白胆固醇 | 1.57 | mmol/L |
低密度脂蛋白胆固醇 | 1.40 | mmol/L |
葡萄糖 | 4.95 | mmol/L |
A.溶解度 B.物质的量浓度 C.质量分数 D.摩尔质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)为原料,制备粗铅,实现铅的再生利用。其工作流程如下图所示:
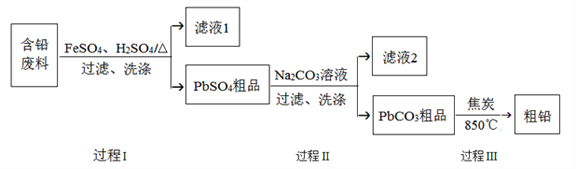
已知:Ksp(PbSO4)=1.6×10-5,Ksp(PbCO3)=3.3×10-14.
(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是__________。
(2)过程Ⅰ中,Fe2+催化过程可表示为:
i:2Fe2++ PbO2+4H++SO42-![]() 2Fe3++PbSO4+2H2O
2Fe3++PbSO4+2H2O
ii: ……
①写出ii的离子方程式:________________。
②下列实验方案可证实上述催化过程。将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红。
b.___________。
(3)过程Ⅱ的目的是脱硫。若滤液2中c(SO42-)=1.6mol/L,c(CO32-)=0.1mol/L,则PbCO3中____(填“是”或“否”)混有PbSO4。
(4)钠离子交换膜固相电解法是从含铅废料中提取铅的一种新工艺,其装置如图所示。将含铅废料投入阴极室,含铅废料中的PbSO4与NaOH溶液发 生反应:PbSO4+3OH-=HPbO2-+SO42-+H2O。
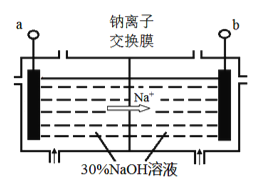
①a与外接电源的________极相连。
②电解过程中,PbO2、PbO、HPbO2-在阴极放电,其中PbO2放电的电极反应式为___________。
③与传统无膜固相电解法相比,使用钠离子交换膜可以 提高Pb元素的利用率,原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。下列说法正确的是( )

A.H2O的分解反应是放热反应
B.氢能源已被普遍使用
C.2 mol 液态H2O具有的总能量低于2 mol H2和1 mol O2的能量
D.氢气不易贮存和运输,无开发利用价值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表中短周期的一部分,其中Y元素的原子序数为M与N元素原子序数之和。下列说法正确的是
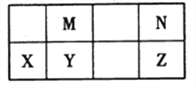
A. 氢化物的稳定性:N >Z,是因为其氢化物分子可形成氢键
B. 元素的非金属性:M > Y,是因为单质M能与YN2反应生成单质Y
C. 熔沸点:YN2>MN2,是因为YN2的分子间作用力强
D. 简单离子的半径:N >X,是因为它们具有相同的电子层结构且X的核电荷数更大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验不能达到实验目的或者实验操作不正确的是
A. 定容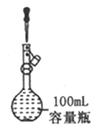
B. 比较硫、碳、硅三种元素
C. 处理尾气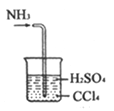
D. 测定黄铜(Cu、Zn素的非金属性强弱合金)中Zn的含量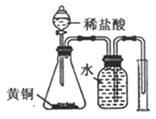
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-选修3:物质结构与性质]
铁氧体是一种磁性材料,具有广泛的应用。 -
(1)基态铁原子的核外电子排布式为[Ar]_______。
(2)工业制备铁氧体常使用水解法,制备时常加入尿素[CO(NH2)2 ]、醋酸钠等碱性物质。尿素分子中四种不同元素的电负性由大至小的顺序是____________;醋酸钠中碳原子的杂化类型是_________。
(3)工业制备铁氧体也可使用沉淀法,制备时常加入氨(NH3)、联氨(N2H4)等弱碱。比较下表中氨(NH3)、联氨(N2H4)的熔沸点,解释其高低的主要原因________。
N2H4 | NH3 | |
熔点/℃ | 2 | -77.8 |
沸点/℃ | 113.5 | -33.5 |
(4)下图是从铁氧体离子晶体Fe3O4中,取出的能体现其晶体结构的一个立方体,则晶体中的氧离子是否构成了面心立方最密堆积______(填“是”或“否”),该立方体是不是Fe3O4的晶胞______(填“是”或“否”),立方体中三价铁离子处于氧离子围成的_____空隙(填空间结构)。
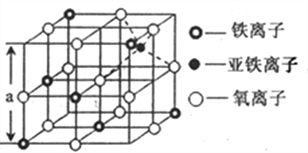
(5)解释该Fe3O4晶体能导电的原因________,根据上图计算Fe3O4晶体的密度_____gcm-3。 (图中a=0.42nm,计算结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积相同的两密闭容器A和B中,保持温度为423K,同时向A、B中分别加入amol、b mol碘化氢(a>b),待反应2HI(g)![]() I2(g) + H2(g)达平衡后,下列说法肯定正确的是()
I2(g) + H2(g)达平衡后,下列说法肯定正确的是()
A. 从反应开始到建立平衡的平均速率:vA<vB
B. 平衡时I2的浓度:c(I2)A=c(I2)B
C. 平衡时碘蒸气在混合气体中的百分含置:A容器大于B容器
D. 平衡时HI的分解率:αA=αB
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com