
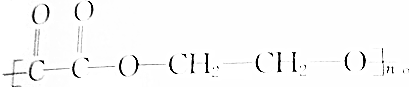 ,1mol该物质与足量NaOH溶液反应,消耗NaOH的物质的量为( )
,1mol该物质与足量NaOH溶液反应,消耗NaOH的物质的量为( )| A. | 2mol | B. | 4mol | C. | 2nmol | D. | 4nmol |
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案科目:高中化学 来源: 题型:选择题
| A. | CH3CHO | B. | CH3CH2CHO | C. | CH3COCH3 | D. | CH3CH2CH2CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
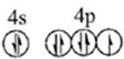 .根据下表提供的第一电离能数,据判断,最有可能生成较稳定的单核阳离子的卤素原子是I
.根据下表提供的第一电离能数,据判断,最有可能生成较稳定的单核阳离子的卤素原子是I| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ•mol-1) | 1681 | 1251 | 1140 | 1008 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
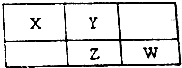
| A. | 原子半径Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>W | |
| C. | 四种元素的单质中,Z单质的熔、沸点最高 | |
| D. | Z的单质与足量的单质Y反应,直接得到一种ZY3的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
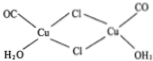 镍和铜都是重要的有色金属材料,回答下列问题:
镍和铜都是重要的有色金属材料,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
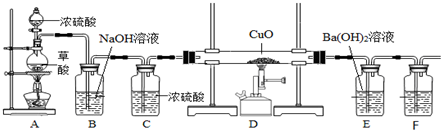
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com