
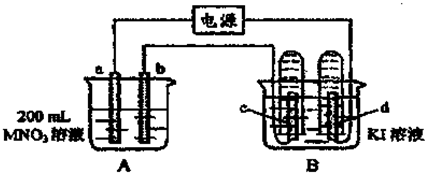
| m |
| n |
| n |
| V |
| 0.0448L |
| 22.4L/mol |
| m |
| n |
| 0.432g |
| 0.004mol |
| 0.02mol |
| 0.2L |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、由水电离出的OH-离子浓度约为1×10-10mol/L |
| B、溶液中存在CH3COOH分子 |
| C、溶液中C(Na+)>C(CH3COO-)>C(H+)>C(OH-) |
| D、溶液中加入少量醋酸pH将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图表示可逆反应A(固)+B(气)?nC(气);反应的热效应为Q(n为正整数)在不同条件下反应混合物中C的百分含量和反应过程所需要的关系曲线.下列有关叙述一定正确的是( )
如图表示可逆反应A(固)+B(气)?nC(气);反应的热效应为Q(n为正整数)在不同条件下反应混合物中C的百分含量和反应过程所需要的关系曲线.下列有关叙述一定正确的是( )| A、其他条件相同,a表示使用了催化剂,b表示没有使用催化剂 |
| B、其他条件相同,若只改变温度,则a比b的温度高且正反应吸热 |
| C、其他条件相同,若只改变压强,则a比b的压强大且n≥2 |
| D、其他条件相同,若只改变A物质的量,则a比b用A物质的量少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 压强/MPa 转化率/% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 滴加溶液A的体积/mL | 5.0 | 10.0 | 15.0 |
| 生成气体的体积/mL(标准状况) | 44.8 | 89.6 | 112 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
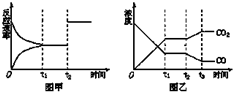 已知:反应①Fe(s)+CO2(g)?FeO(s)+CO(g);△H=Q1,平衡常数为K1,
已知:反应①Fe(s)+CO2(g)?FeO(s)+CO(g);△H=Q1,平衡常数为K1,| T(K) | K1 | K2 |
| 700 | 1.47 | 2.38 |
| 900 | 2.15 | 1.67 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com